La Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas recomienda realizar ecocardiografía transtorácica (ETT) en todo menor de 2 años con soplo. En 2014 la Asociación Americana de Pediatría publicó los primeros criterios de uso apropiado de ETT pediátrica ambulatoria (CUA) como guía para promover un uso costo-eficiente de la misma. Nuestro objetivo fue analizar los CUA y otros factores clínicos como predictores de cardiopatía congénita (CC) en menores de 2 años con soplo para desarrollar una estrategia de derivación eficiente y segura.
Pacientes y métodoEstudio de casos y controles en menores de 2 años derivados por pediatría de atención primaria a cardiología pediátrica por soplo durante 4 años. Mediante análisis multivariante se determinó un modelo predictivo de CC.
ResultadosSe incluyeron 688 pacientes con 129 casos (19%) de CC. La edad menor a 3 meses (odds ratio ajustada [ORa] 3,8[1,5-8,4]; p=0,030) y cumplimiento de CUA (ORa 16,3[9,4-28,3]; p<0,001) fueron predictores de CC. La presencia de infección concurrente (ORa 0,6 [0,2-0,8]; p<0,001), y un screening neonatal con pulsioximetría negativo (ORa 0,1 [0,05-0,4]; p=0,001) disminuyeron el riesgo de CC. La estrategia de derivación que incluía estos criterios presentó una sensibilidad 98%, especificidad 39%, VPP 27% y VPN 99%. Dejaría de diagnosticar un 2% de CC (todas leves) y reduciría un 32% el número de ETT realizadas respecto a la estrategia actual.
ConclusiónLa derivación por pediatría de atención primaria para ETT de niños que sean menores de 3 meses, cumplan CUA, no presenten infección concurrente, o no tengan SP, constituye una estrategia eficiente y segura para el manejo de soplo en menores de 2 años.
Current guidelines in Spain recommend performing transthoracic echocardiography (TTE) in all children under 2 years of age with a heart murmur. In 2014, the American Paediatric Association published the first appropriate use criteria (AUC) for outpatient paediatric transthoracic echocardiography (TTE) to promote its cost-efficient use. The aim of this article is to analyse the AUC and other clinical factors as predictors of congenital heart disease (CHD) in children less than 2 years of age with a heart murmur, and to develop a safe and efficient referral strategy.
Patients and methodCase-control study conducted with children less than 2 years of age, referred from Paediatric Primary Care to Paediatric Cardiology during a 4-year study. A predictive model for CHD was determined using multivariate analysis.
ResultsA total of 688 patients were included, with 129 (19%) cases of CHD. An age less than 3 months (adjusted odds ratio [ORa] 3.8 [1.5-8.4], p=.030) and fulfilling AUC (ORa 16.3 [9.4-28.3], p<.001) were predictors of CHD. Concurrent infection (ORa 0.6 [0.2-0.8], p<.001) and a negative neonatal screening with pulse oximetry (ORa 0.1 [0.05-0.4], p=.001) decreased the risk of CHD. The referral strategy that included these criteria had a 98% sensitivity, 39% specificity, and positive and negative predictive values of 27% and 99%, respectively. It could not diagnose 2% of CHD (all mild), and showed a 32% TTE reduction rate compared to our current strategy.
ConclusionTo refer children less than 3 months old, fulfilling AUC, without a concurrent infection, or without negative neonatal pulse oximetry screening, is a safe and efficient strategy for the management of heart murmur in children under 2 years of age.
El soplo es el motivo de derivación más frecuente desde pediatría de atención primaria (PAP) a cardiología pediátrica (CP)1–3. Se trata de un hallazgo exploratorio común (prevalencia 5-80%) que puede ser el signo guía para el diagnóstico de cardiopatías congénitas (CC)4,5. La ecocardiografía transtorácica (ETT) es el método diagnóstico de elección para CC. Es una técnica segura, accesible, rápidamente interpretable y con gran precisión diagnóstica en manos expertas. La Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC) recomienda derivar para ETT a todo menor de 2 años aunque esté asintomático y el soplo parezca inocente6. Esto se justifica por el diagnóstico de CC ocultas al examen clínico, la falta de colaboración en la exploración física a esta edad, y para evitar la ansiedad familiar, revisiones innecesarias o restricciones en actividad física del niño.
Sin embargo, la ETT no es una técnica costo-eficiente para el manejo del soplo en pediatría7–10. En 2014, la Academia Americana de Pediatría estableció los primeros criterios de uso apropiado para la ETT inicial en CP ambulatoria (CUA)11. Este documento, diseñado para realizar un uso apropiado y rentable de la ETT, incluye 113 indicaciones para ETT, clasificando como apropiadas aquellas en las que se espera que añada información al juicio clínico inicial y el beneficio para el paciente supere las consecuencias negativas esperadas (incluyendo el coste económico, los riesgos del procedimiento y el impacto posterior del rendimiento diagnóstico deficiente de la prueba). En un estudio multicéntrico que valoraba la implementación de los CUA12, el soplo fue la indicación más común para ETT (30%), siendo el soplo inocente la indicación más frecuentemente clasificada como no apropiada. Además, la derivación apropiada para la indicación soplo presentó buena precisión diagnóstica para detección de CC (sensibilidad 95%, especificidad 33%, VPP 46%, VPN 91%). Por tanto, el uso racional y eficiente de la ETT para el estudio de un soplo en pediatría basado en los CUA puede constituir la base para intervenciones de calidad reduciendo de forma segura la tasa de TTE realizada por soplos inocentes.
Los objetivos de este trabajo son: analizar los CUA y otros factores clínicos no incluidos en ellos como predictores de CC en menores de 2 años; a raíz de estos resultados establecer una estrategia de derivación y evaluar su precisión diagnóstica, seguridad y tasa de reducción de ecocardiografía al aplicarla respecto a las actuales recomendaciones de la SECPCC.
Pacientes y métodoDiseño, población y marco del estudio: estudio de casos y controles realizado en la unidad de CP de un hospital de tercer nivel desde enero de 2013 a enero de 2017.
Criterios de inclusión: menores de 2 años de edad derivados por primera vez por PAP a consultas externas de CP para valoración de soplo. Se realizó ecocardiografía a todos los pacientes. Aquellos pacientes diagnosticados de CC fueron definidos como casos, y fueron divididos en leve si solo requirieron seguimiento, moderada si precisaron algún tipo de tratamiento (fármacos, cateterismo o cirugía) no urgente, y grave si precisaron tratamiento urgente. En caso de coexistir más de una cardiopatía se seleccionó la más severa para clasificar al paciente. Los pacientes con estudio normal o presencia de hallazgos incidentales (estenosis ligera de ramas pulmonares periféricas, foramen oval permeable, vena cava superior izquierda persistente, ductus o fístula coronaria mínimos en neonatos, insuficiencias valvulares auriculoventriculares mínimas, insuficiencia pulmonar ligera) fueron definidos como controles. El reclutamiento de los casos y los controles fue secuencial, sin realizarse emparejamiento.
Criterios de exclusión: derivación desde ámbito diferente a PAP, ETT previa, falta de variables en las historias clínicas.
La información para el estudio se extrajo de la revisión de historias clínicas por parte de un único observador externo e independiente a CP, que recogió las siguientes variables: edad, sexo, antecedentes de CC en familiares de primer grado, antecedentes personales de factores claramente asociados a CC (síndromes malformativos, cromosomopatías, tóxicos y fármacos durante la gestación, infección vertical perinatal, diabetes pregestacional), presencia de screening neonatal de CC con pulsioximetría realizado y con resultado negativo (SPN), presencia de infección concurrente (IC) cuando se detectó el soplo por PAP, tipo de soplo auscultado por el CP (normal si no auscultó soplo; inocente si auscultó soplo con las siguientes características: corta duración (proto/mesosistólico), baja intensidad (1-2/6), tono musical o suave, aumento en decúbito supino, ausencia de ruidos patológicos añadidos; orgánico si presentaba alguna de las siguientes características: holosistólico, diastólico o continuo, intensidad > 3/6, thrill torácico, tonalidad ruda o áspera, segundo tono anormal, presencia de clicks, aumento de intensidad sentado o con Valsalva), presencia de síntomas o signos asociados a CC detectados por CP (fallo de medro, cansancio y sudoración con las tomas o el llanto, infecciones respiratorias recurrentes, cianosis central detectada con pulsioximetría, diferencia de pulsos entre miembros superiores e inferiores, hipertensión arterial, taquipnea para la edad, taquicardia para la edad, precordio hiperdinámico, thrill torácico, hepatomegalia), tipo de CC, tratamiento precisado (farmacológico, hemodinámico o quirúrgico), evolución clínica de CC (persistencia, si la CC persistía al final del periodo de estudio; o resolución espontánea, si la CC se resolvió sin necesidad de intervención alguna durante el periodo de seguimiento), tiempo de seguimiento, tiempo para la resolución espontánea de cardiopatía.
Tipo de derivación según CUA: derivación adecuada (indicaciones 40 y 41 del documento; soplo orgánico a la auscultación o presumiblemente inocente a la auscultación pero asociado a signos clínicos de alarma o factores de riesgo personal o familiar para CC) y derivación no adecuada (indicación 39 del documento: ausencia de soplo o soplo inocente a la auscultación sin signos clínicos de alarma ni factores de riesgo personal o familiar para CC)10.
Estrategia de estudio: se compararon casos y controles para encontrar diferencias en las variables recogidas y se determinó cuáles resultaron predictores independientes de CC. A partir de estos resultados se diseñó una estrategia de derivación que incluía dichas variables y se analizó su precisión diagnóstica para detectar CC, su seguridad (número y tipo de CC no diagnosticadas, así como su evolución), y la tasa de reducción de ecocardiografía respecto a la estrategia de derivar a todos los pacientes menores de 2 años.
Análisis estadístico: se realizó un análisis descriptivo en el que las variables cualitativas se expresan en forma de frecuencia y porcentaje y se comparan entre los casos y los controles mediante el test de la Chi cuadrado o el test exacto de Fisher cuando fue necesario. Las relaciones entre las variables se evaluaron mediante la odds ratio (OR). Las variables cuantitativas se expresan en forma de media y desviación estándar (DE), o mediana y rango intercuartil (IQR), en función de la distribución de la variable; se utilizó el test de Kolmogorov-Smirnov para comprobar su distribución normal y se compararon su frecuencia relativa entre casos y controles con la prueba de t de Student. Posteriormente se calculó un modelo de regresión logística multivariante con finalidad predictiva para detectar CC. Para ello introducimos en el modelo las variables clínicamente relevantes o que resultaron significativas en el análisis bivariante. Para calcular el mejor modelo se utilizó el método de inclusión por pasos hacia atrás. La relación de CC con las variables que se consideraron como factores predictores independientes se expresa como OR ajustada (ORa). Utilizando el modelo final de predicción de CC se calculó su sensibilidad, especificidad, valor predictivo positivo y negativo. Se consideró estadísticamente significativo un valor de p < 0,05 para un intervalo de confianza del 95% (IC95%). Los datos se analizaron con el programa IBM© PASW STATISTICS© v 18.0 (IBM Corporation, Somers, NY, EE. UU.).
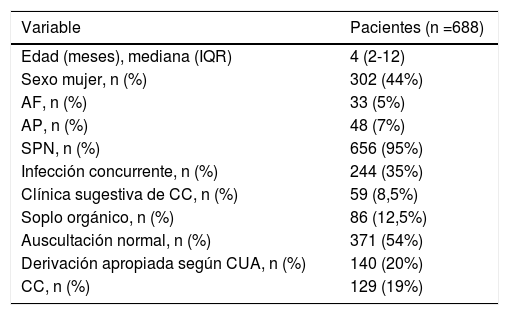
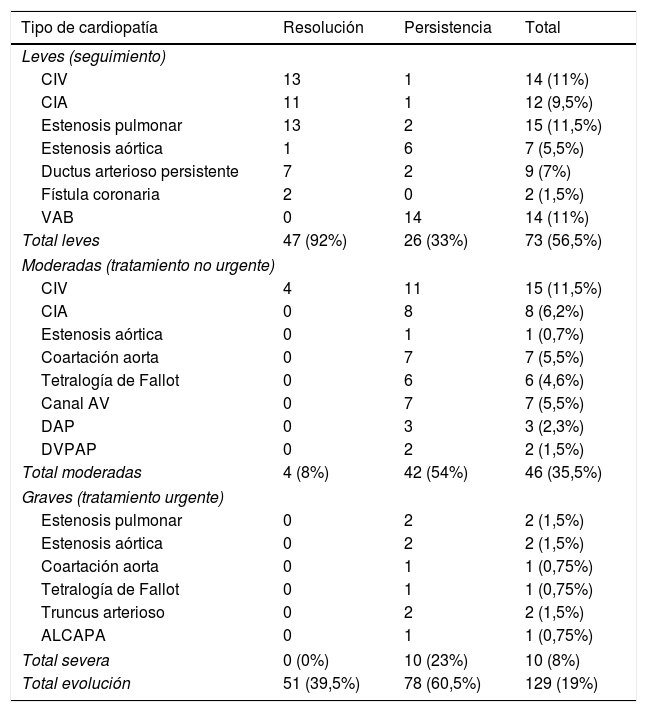
ResultadosDescriptivo (tablas 1 y 2): se incluyeron 688 pacientes detectándose 129 casos (19%) de CC (57% leves, 35% moderadas, y 8% graves). El 39,5% de CC se resolvieron espontáneamente en 11,3 (±6,8) meses durante un periodo de seguimiento de 3,7 (±1,7) años. El tiempo transcurrido entre la derivación por AP y la consulta en CP fue de 0,9 (+/- 0,4) meses.
Datos demográficos y clínicos de la población de estudio
| Variable | Pacientes (n =688) |
|---|---|
| Edad (meses), mediana (IQR) | 4 (2-12) |
| Sexo mujer, n (%) | 302 (44%) |
| AF, n (%) | 33 (5%) |
| AP, n (%) | 48 (7%) |
| SPN, n (%) | 656 (95%) |
| Infección concurrente, n (%) | 244 (35%) |
| Clínica sugestiva de CC, n (%) | 59 (8,5%) |
| Soplo orgánico, n (%) | 86 (12,5%) |
| Auscultación normal, n (%) | 371 (54%) |
| Derivación apropiada según CUA, n (%) | 140 (20%) |
| CC, n (%) | 129 (19%) |
AF: antecedentes familiares de CC; AP: antecedentes personales de factores de riesgo de CC; CC: cardiopatía congénita; CUA: criterios de derivación de la Academia Americana de Pediatría; IQR: rango intercuartílico; SPN: screening neonatal de CC con pulsioximetría realizado y con resultado negativo.
Tipos de cardiopatías congénitas diagnosticadas y evolución
| Tipo de cardiopatía | Resolución | Persistencia | Total |
|---|---|---|---|
| Leves (seguimiento) | |||
| CIV | 13 | 1 | 14 (11%) |
| CIA | 11 | 1 | 12 (9,5%) |
| Estenosis pulmonar | 13 | 2 | 15 (11,5%) |
| Estenosis aórtica | 1 | 6 | 7 (5,5%) |
| Ductus arterioso persistente | 7 | 2 | 9 (7%) |
| Fístula coronaria | 2 | 0 | 2 (1,5%) |
| VAB | 0 | 14 | 14 (11%) |
| Total leves | 47 (92%) | 26 (33%) | 73 (56,5%) |
| Moderadas (tratamiento no urgente) | |||
| CIV | 4 | 11 | 15 (11,5%) |
| CIA | 0 | 8 | 8 (6,2%) |
| Estenosis aórtica | 0 | 1 | 1 (0,7%) |
| Coartación aorta | 0 | 7 | 7 (5,5%) |
| Tetralogía de Fallot | 0 | 6 | 6 (4,6%) |
| Canal AV | 0 | 7 | 7 (5,5%) |
| DAP | 0 | 3 | 3 (2,3%) |
| DVPAP | 0 | 2 | 2 (1,5%) |
| Total moderadas | 4 (8%) | 42 (54%) | 46 (35,5%) |
| Graves (tratamiento urgente) | |||
| Estenosis pulmonar | 0 | 2 | 2 (1,5%) |
| Estenosis aórtica | 0 | 2 | 2 (1,5%) |
| Coartación aorta | 0 | 1 | 1 (0,75%) |
| Tetralogía de Fallot | 0 | 1 | 1 (0,75%) |
| Truncus arterioso | 0 | 2 | 2 (1,5%) |
| ALCAPA | 0 | 1 | 1 (0,75%) |
| Total severa | 0 (0%) | 10 (23%) | 10 (8%) |
| Total evolución | 51 (39,5%) | 78 (60,5%) | 129 (19%) |
ALCAPA: origen anómalo de la arteria coronaria izquierda de la arteria pulmonar; AV: auriculoventricular; CIA: comunicación interauricular; CIV: comunicación interventricular; DAP: ductus arterioso persistente; DVPAP: drenaje venoso pulmonar anómalo parcial; VAB: válvula aórtica bicúspide; VAO: válvula aórtica bicúspide.
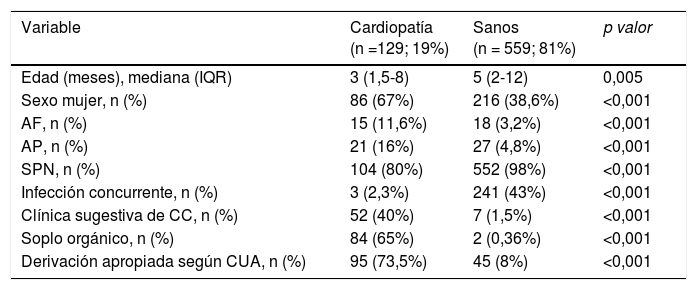
Factores predictores de cardiopatía congénita: se encontraron diferencias estadísticamente significativas en las siguientes variables: edad, sexo femenino, antecedentes familiares, antecedentes personales, SPN, IC, tipo de soplo orgánico, clínica cardiológica, y tipo de derivación según CUA (tabla 3).
Comparativa de las variables analizadas entre casos y controles
| Variable | Cardiopatía (n =129; 19%) | Sanos (n = 559; 81%) | p valor |
|---|---|---|---|
| Edad (meses), mediana (IQR) | 3 (1,5-8) | 5 (2-12) | 0,005 |
| Sexo mujer, n (%) | 86 (67%) | 216 (38,6%) | <0,001 |
| AF, n (%) | 15 (11,6%) | 18 (3,2%) | <0,001 |
| AP, n (%) | 21 (16%) | 27 (4,8%) | <0,001 |
| SPN, n (%) | 104 (80%) | 552 (98%) | <0,001 |
| Infección concurrente, n (%) | 3 (2,3%) | 241 (43%) | <0,001 |
| Clínica sugestiva de CC, n (%) | 52 (40%) | 7 (1,5%) | <0,001 |
| Soplo orgánico, n (%) | 84 (65%) | 2 (0,36%) | <0,001 |
| Derivación apropiada según CUA, n (%) | 95 (73,5%) | 45 (8%) | <0,001 |
AF: antecedentes familiares de CC; AP: antecedentes personales de factores de riesgo de CC; CC: cardiopatía congénita; CUA: criterios de derivación de la Academia Americana de Pediatría; IQR: rango intercuartílico; SPN: screening neonatal de CC con pulsioximetría realizado y con resultado negativo.
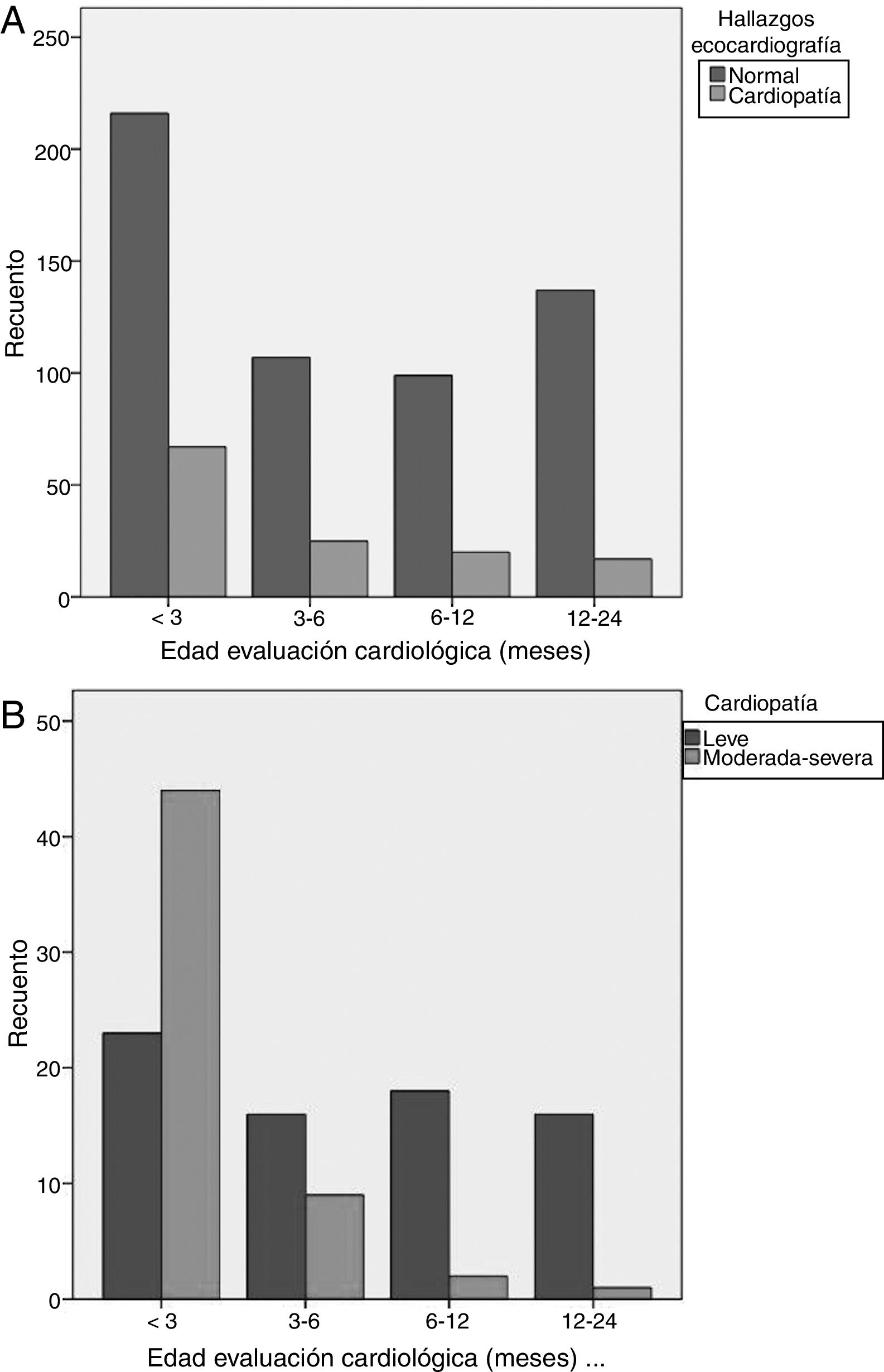
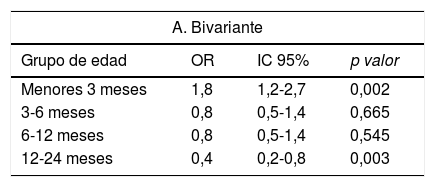
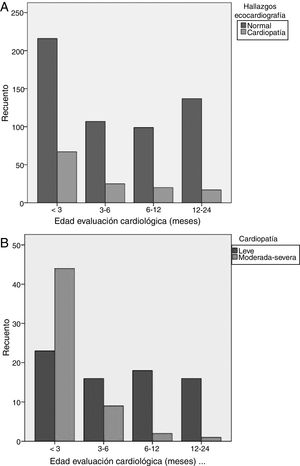
Edad (fig. 1): los menores de 3 meses presentaron mayor riesgo de CC. El 52% de casos de todas las CC, el 78% de las CC moderadas y el 80% de las CC graves, se presentaron en este grupo. La edad 12-24 meses y 6-12 meses se asociaron a menor riesgo de CC. El 92% de los casos detectados por encima de 6 meses de edad eran CC leves.
Variables incluidas en los CUA: el tipo de derivación adecuada se asoció a un mayor riesgo de presentar CC. El 68% de los pacientes con derivación adecuada presentaban CC, incluyendo todos los casos de CC grave y el 93% de las moderadas. Todas las variables que determinan la derivación adecuada incrementaban de forma significativa el riesgo de CC, siendo el tipo de soplo orgánico y la clínica sugestiva de CC los parámetros con mayor riesgo para detectar CC.
Variables no incluidas en los CUA: la presencia de SPN se asoció a menor riesgo de CC. Se encontró CC grave detectable por screening en el 19% de los pacientes sin SPN. La IC se asoció a menor riesgo de presentar CC. El 22% de los pacientes sin IC presentó una CC, y todas las CC que se detectaron en el grupo con IC eran leves.
La tabla 4 recoge los resultados de los análisis bivariante y multivariante realizados.
Análisis del riesgo de presentar CC en función del grupo de edad, variables CUA y variables no CUA
| A. Bivariante | |||
|---|---|---|---|
| Grupo de edad | OR | IC 95% | p valor |
| Menores 3 meses | 1,8 | 1,2-2,7 | 0,002 |
| 3-6 meses | 0,8 | 0,5-1,4 | 0,665 |
| 6-12 meses | 0,8 | 0,5-1,4 | 0,545 |
| 12-24 meses | 0,4 | 0,2-0,8 | 0,003 |
| Variables CUA | OR | IC 95% | p valor |
|---|---|---|---|
| Soplo orgánico | 519,8 | 123,8-2182,8 | < 0,001 |
| Clínica sugestiva de CC | 53,2 | 23,3-121,4 | < 0,001 |
| AP | 3,8 | 2 -7 | < 0,001 |
| AF | 3,9 | 1,9-8 | < 0,001 |
| Derivación adecuada según CUA | 31,9 | 19,4-52,4 | < 0,001 |
| Variable no CUA | OR | IC 95% | p valor |
|---|---|---|---|
| SPN | 0,5 | 0,2-0,7 | < 0,001 |
| Infección concurrente | 0,3 | 0,01-0,9 | < 0,001 |
| B. Multivariante | |||
|---|---|---|---|
| Variable | ORa | IC 95% | p valor |
| Menores 3 meses | 3,8 | 1,5-8,4 | 0,030 |
| 12-24 meses | 0,6 | 0,3-2,5 | 0,402 |
| Infección concurrente | 0,6 | 0,2-0,8 | <0,001 |
| SPN | 0,1 | 0,05-0,4 | 0,001 |
| Derivación adecuada según CUA | 16,3 | 9,4-28,3 | <0,001 |
AF: antecedentes familiares de CC; AP: antecedentes personales de factores de riesgo de CC; CC: cardiopatía congénita; CUA: criterios de derivación de la Academia Americana de Pediatría; Ora: odss ratio ajustada (el grupo usado como referencia para calcular ORa de los grupos de edad fue el de pacientes entre 3-12 meses); SPN: screening neonatal de CC con pulsioximetría realizado y con resultado negativo.
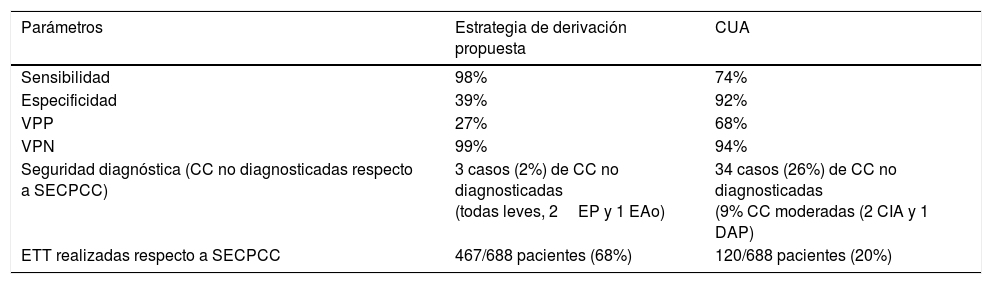
Estrategia de derivación alternativa: a partir de los resultados del análisis multivariante se escogió como estrategia de derivación alternativa realizar ETT a aquellos pacientes que cumplían alguno de los siguientes criterios: tipo de derivación adecuada según CUA, edad menor 3 meses, ausencia de SPN, o detección de soplo sin IC. Esta estrategia presentó sensibilidad 98%, especificidad 40%, VPP 27% y VPN 99% para detectar CC. Al aplicarla dejaría de diagnosticar un 2% de CC, todas CC leves con buena evolución durante el periodo de seguimiento. La nueva estrategia de derivación seleccionada incluiría a 468 pacientes, dejando de realizar un total de 220 ETT (reducción del 32% respecto a las recomendaciones de SECPCC). La tabla 5 compara la precisión diagnóstica, seguridad y tasa de reducción de ETT de la estrategia elegida y los CUA respecto a las recomendaciones de la SECPCC.
Comparativa entre la estrategia de derivación propuesta y los CUA
| Parámetros | Estrategia de derivación propuesta | CUA |
|---|---|---|
| Sensibilidad | 98% | 74% |
| Especificidad | 39% | 92% |
| VPP | 27% | 68% |
| VPN | 99% | 94% |
| Seguridad diagnóstica (CC no diagnosticadas respecto a SECPCC) | 3 casos (2%) de CC no diagnosticadas (todas leves, 2EP y 1 EAo) | 34 casos (26%) de CC no diagnosticadas (9% CC moderadas (2 CIA y 1 DAP) |
| ETT realizadas respecto a SECPCC | 467/688 pacientes (68%) | 120/688 pacientes (20%) |
CC: cardiopatía congénita; CIA: comunicación interauricular; CUA: criterios de uso adecuado de ecocardiografía ambulatoria pediátrica; DAP: ductus arterioso persistente; Eao: estenosis aórtica; EP: estenosis pulmonar; ETT: ecocardiografía transtorácica; SECPCC: Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas.
El uso excesivo y aumento de costes de técnicas de imagen cardiaca en relación con otros aspectos de la atención médica hace necesario identificar enfoques de alto rendimiento y seguridad para evaluar problemas con elevada prevalencia como el soplo en pediatría9,13,14. Los resultados de nuestro estudio sugieren que la clave sería la priorización basada en la evaluación clínica del PAP, teniendo en cuenta sobre todo los CUA de la Academia Americana de Pediatría, la edad del paciente, la realización de SPN y la presencia de IC.
La mayoría de los niños derivados por soplo a CP no presentan CC. Coincidiendo con lo publicado anteriormente9,10,15 nuestro rendimiento diagnóstico de ETT para CC fue bajo (19%), y solo el 20% de nuestra muestra tenía derivación adecuada, debido sobre todo a una gran proporción de derivaciones por soplo inocente. Realizar ETT a todos los pacientes con soplo supone un gasto económico importante. Yi et al.7 demostraron que la derivación universal para ETT supone un coste incremental de 158.000 $ por caso adicional detectado de CC de cualquier gravedad. En nuestro caso esto supondría, con 129 CC detectadas durante el periodo de estudio (muchas de ellas leves con resolución espontánea), un coste económico de 20.382.000 de euros (5.095.500 euros/año). Además el uso indiscriminado de ETT puede ser contraproducente, ya que puede revelar detalles incidentales que den lugar a revisiones innecesarias o incremento de la ansiedad de los padres, que persiste en un 7-10% de los casos10,16,17. Varios estudios sugieren que el examen clínico por CP sería una estrategia adecuada para seleccionar pacientes con soplo para ETT7,8,13. Sin embargo, la ETT es accesible, segura y con alta precisión diagnóstica, lo que unido a la ansiedad y expectativas de la familia por su realización y el aumento de demandas por errores médicos, hace difícil no realizarla una vez que el paciente llega a CP, aunque el soplo parezca inocente. Por tanto, la derivación para la evaluación de un soplo en CP implica realizar siempre una ETT, al menos en nuestro medio, y la detección de CC en menores de 2 años con soplo sería más eficiente siguiendo algún tipo de cribado, que en nuestra opinión, depende del uso racional de derivaciones a CP por parte de PAP.
Determinar qué soplos precisan ETT supone un reto diagnóstico para PAP18,19 que, debido a una conjunción de factores (ausencia de guías clínicas, limitación de las habilidades clínicas y experiencia del PAP para soplo, sobrecarga asistencial, presión legal, ansiedad familiar, gran disponibilidad de ETT ambulatoria,…), suele tener un umbral bajo de derivación18. En este sentido varios estudios1,20 constatan que los pacientes remitidos por soplo son un área de actividad creciente en CP, incrementándose hasta un 20% cada 5 años. Además existe una disminución del rendimiento diagnóstico de ETT realizadas por soplo del 50% al 16% en las últimas décadas que, junto a una incidencia de CC que se mantiene constante (<1%), sugieren un cambio de patrón en el manejo del soplo en PAP, con un aumento de la tasa de derivación de soplo inocente1,10,20.
Los CUA se publicaron para guiar la toma de decisiones en este asunto11. A pesar de su adecuada precisión diagnóstica para CC12, nuestros resultados sugieren que su uso exclusivo, dada su moderada sensibilidad (78%), no sería una adecuada estrategia de screening para patologías importantes como las CC. Esto es debido a la alta prevalencia de CC leves encontrada, habitualmente lesiones asintomáticas y con exploración normal. Dentro de los parámetros analizados en los CUA, la auscultación de un soplo orgánico por parte de CP y la presencia de clínica sugestiva de CC fue lo que más riesgo asociaba de detectar CC. Esto es consistente con los resultados del estudio de implementación de los CUA12, donde la indicación 40 (auscultación de soplo orgánico) fue la que mayor rendimiento diagnóstico obtuvo para la detección de CC (40%). Aunque los hallazgos auscultatorios de un soplo inocente están bien definidos3,21, su adecuada valoración depende en gran medida de las habilidades clínicas, experiencia y nivel de autoconfianza de PAP. No realizamos análisis de la precisión diagnóstica de la auscultación de PAP, pero diferentes estudios demuestran que esta no es adecuada22,23, y sería conveniente mejorar el entrenamiento en la auscultación durante la formación pediátrica24,25. Por todo ello, aunque los CUA detectarían bien la mayoría de CC moderadas y graves, puede ser prudente incluir criterios adicionales para ayudar a PAP a clasificar correctamente a los menores de 2 años con soplo.
La edad es un factor fundamental en el manejo del soplo. La mayoría de las CC se diagnostica a edades más tempranas, debido sobre todo al aumento del diagnóstico precoz con ecocardiografía prenatal y neonatal26, el screening con pulsioximetría27–29, y los múltiples controles de salud en la infancia. Además, la gran mayoría de las muertes extrahospitalarias por CC no diagnosticada ocurren antes de las 12 semanas de vida, y casi todas las CC graves se presentan antes del año de vida30,31. Por tanto las estrategias para la evaluación de soplo deben ser adaptadas a la edad, debiendo existir un umbral más bajo de derivación a menor edad3,10,14,15,26. En nuestro estudio la edad menor de 3 meses fue un factor predictor independiente de CC en pacientes con soplo. Además el riesgo de CC disminuyó en mayores de 6 meses, por lo que no parecería necesario derivar a todos los menores de 2 años con soplo para descartar una CC.
El uso del screening de CC con pulsioximetría en neonatos ha demostrado una adecuada precisión para la detección de CC grave27,28,32,33. Hasta el 30% de estas CC se diagnostican de forma tardía sin screening. Los resultados de nuestro estudio son similares encontrando CC grave en el 19% de la población sin SPN, asociándose un SPN a menor riesgo de padecer CC. Dado que su uso universal no está aún implantado, sería un factor importante a tener en cuenta al evaluar a estos pacientes.
La presencia de soplo en el contexto de IC es muy frecuente en menores de 2 años (35% de nuestra población) y resultó un factor protector independiente para CC. Es destacable que el soplo desapareció en el 54% de los pacientes al resolverse la IC. Por tanto la presencia de una IC hace improbable la presencia de CC4. Al ser el tiempo medio de espera para su valoración por CP un mes, los resultados de nuestro estudio sugieren que puede ser recomendable esperar al menos ese tiempo antes de derivarlo para ETT.
LimitacionesLas principales limitaciones del presente estudio fueron su carácter retrospectivo y que el observador independiente se basó exclusivamente en lo registrado en las historias clínicas de los pacientes por CP. Esto puede constituir una importante limitación a la hora de incluir variables en un modelo de predicción para valorar la estrategia de derivación de PAP a CP, ya que la valoración del PAP y el CP pueden diferir. Sin embargo, datos como SPN, los antecedentes personales y familiares suelen ser fijos en el tiempo, la presencia de IC y la clínica de CC registradas se refieren siempre al momento de la detección del soplo por PAP, y la exploración física (sobre todo la auscultación) del CP es el patrón de referencia para la valoración de soplo, siendo por tanto la que debería realizar idealmente el PAP. Por todo ello consideramos que la información registrada por CP es extrapolable a la que debería recoger el PAP en la valoración de soplo, y solo constituiría una limitación importante si el objetivo del estudio fuera comparar la precisión diagnóstica del PAP respecto al CP.
ConclusionesEl uso conjunto de los CUA y los otros factores propuestos en nuestro estudio parece una estrategia eficiente, segura y que reduce el número de ETT para el manejo de soplo en menores de 2 años respecto a las actuales recomendaciones de la SECPCC.
Intervenciones educativas basadas en estos resultados pueden ayudar a mejorar el uso de la ETT para el estudio de soplo por parte de PAP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo ha sido presentado previamente al 65 Congreso de la AEP, Santiago de Compostela, 1, 2 y 3 de junio de 2017.