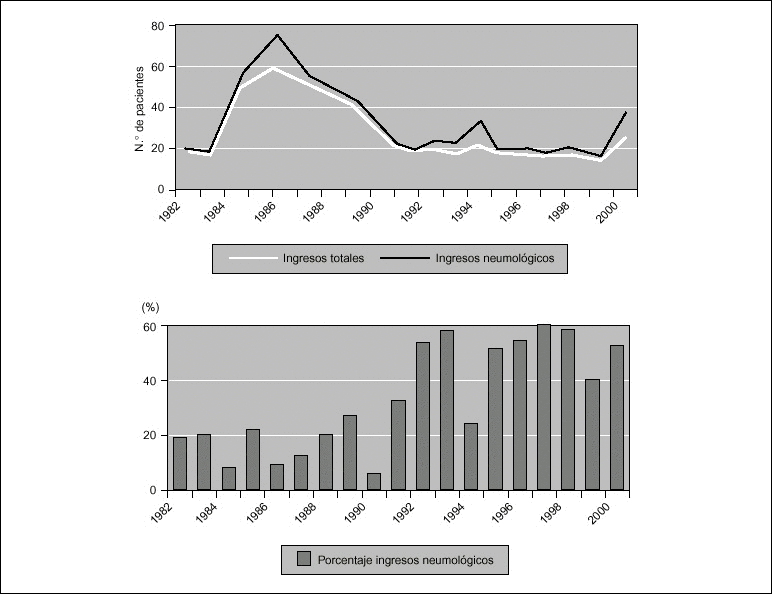
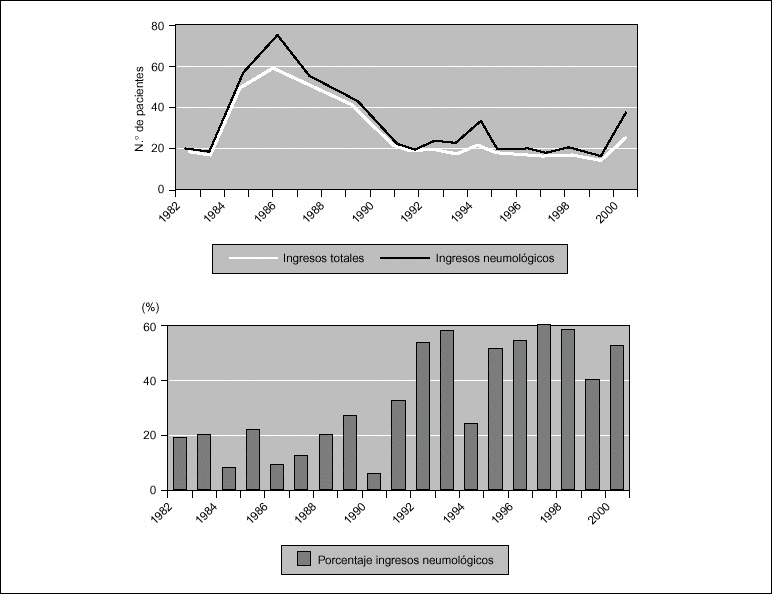
Introducción
La infección respiratoria, se encuentra entre las principales causas de morbilidad, tanto en niños como en adultos. Solamente la neumonía es causa de casi el 10% de los ingresos en una Unidad de Cuidados intensivos. El enfoque del paciente está dirigido a conseguir en primer lugar un diagnóstico etiológico y efectuar un tratamiento basado en lo posible, en la respuesta del agente infectante a un determinado fármaco, evitando el empleo indiscriminado de antibióticos. Sin embargo la utilización de los métodos decultivo habituales (el cultivo de alguno de los cuales es difícil o incluso imposible en el laboratorio) y los métodos de identificación, están limitados por el tiempo, por su especificidad y por la sensibilidad. La aparición de resistencias frente a bacterias comúnmente involucradas en las infecciones en niños (S. pneumoniae, H. influenzae, M. Catarrhalis y S. aureus), requiere información sobre la susceptibilidad de los agentes aislados.
A pesar del empleo intensivo de métodos de diagnóstico, más del 50% de los casos de neumonía quedan sin diagnóstico etiológico.
Iniciamos la exposición con un repaso a los medios más idóneos para conseguir la muestra, las nuevas tecnologías y su aplicación clínica1.
Muestras para estudio
Secreciones nasofaríngeas. Sus hallazgos se correlacionan muy poco con los del parénquima pulmonar. Los cultivos de aspirados nasofaríngeos, no tienen valor diagnóstico en pacientes en edad preescolar y deben ser interpretados con cautela en pacientes mayorcitos2.
Esputo. Pese a sus limitaciones en cuanto a la sensibilidad y especificidad, la tinción de Gram y el cultivo constituyen herramientas importantes en la evaluación microbiológica. Entre el 25 y el 40 % de las muestras no son aptas para su estudio por diversos motivos. La presencia de muchas células epiteliales es signo de contaminación, mientras que cuando están en pequeño número y dominan los
PMN, la sospecha de infección es mayor. La presencia de moco "strading" apoya la existencia de un componente inflamatorio evidente3. El hallazgo de 25 leucocitos y 10 células epiteliales, puede considerarse como indicativo de infección. Existe la posibilidad de conseguir el esputo mediante la inhalación de suero salino hipertónico, en pacientes incapaces de expectorar (esputo inducido), su utilidad todavía no ha sido establecida de forma concreta4. La identificación de 106 ufc/ml de un patógeno en un esputo válido debe considerarse como positivo.
Secreciones traqueobronquiales. Obtenidas por aspirado broncoscópico o lavado bronquial, sólo se justifican en el medio hospitalario.
Lavado broncoalveolar (LBA). Se efectúa también en el medio hospitalario en pacientes con evolución tórpida, en pacientes ventilados e inmunocomprometidos. Es especialmente útil en la detección de patógenos oportunistas, hongos o parásitos. Positividad a partir de 104ufc/ml. Tiene una elevada sensibilidad.
Cepillado bronquial mediante catéter telescopado (PBS). Tiene las mismas indicaciones que la anterior y su rendimiento está superado por el LBA. Se recomienda como punto de corte para diferenciar entre patógenos y organismos de bajo nivel de colonización, la presencia de 103 ufc/ml5,6. Su especificidad es elevada comparándola con el LBA.
Líquido pleural. Sólo está presente en una muy baja proporción de niños con neumonía comunitaria, en cuyo caso constituye el material óptimo para el examen microscópico directo y para el cultivo bacteriano.
Punción pulmonar. Un germen aislado de un aspirado efectuado con aguja es una prueba contundente de la etiología. Tiene una sensibilidad cercana al 80%, pero sólo se justifica en el medio hospitalario.
Tests diagnósticos
En las tablas 1 y 2 se exponen los distintos tests diagnósticos y su utilización en los distintos niveles asistenciales.
Detección de antígenos
Muchos antígenos polisacáridos solubles pueden ser detectados mediante métodos inmunológicos (anticuerpos monoclonales o policlonales), como coaglutinación (coA), contrainmunoelectroforesis (CIE), aglutinación con látex, inmunoensayo enzimático (EIA) y anticuerpos con inmunofluorescencia directa (DFA)7,8. La técnica de la detección de antígenos está basada en la unión de un anticuerpo monoclonal a una fase sólida o a un marcador fluorescente con el fin de conseguir identificar el antígeno. Son métodos casi tan rápidos como la tinción de Gram y mucho másrápidos que el cultivo cuantitativo aunque en contraposición son más caros y requieren más tiempo. Se aplican a las muestras de esputo, aunque también pueden utilizarse en suero, orina y líquidos corporales.
Detección de antígenos bacterianos. Se efectúa mediante CIE, aglutinación de partículas de látex o ELISA, siendo este último el método más sensible y específico. Tiene valor cuando las muestras analizadas se encuentran libres del antígeno.
1.Antígeno neumocócico. Se han utilizado varios métodos para poder identificar antígenos polisacáridos capsulares y polisacárido C de la pared. Las muestras pueden ser sangre, esputo y orina.
De entre sus ventajas, destacamos: mejor rendimiento, mayor rapidez, menor modificación por los antibióticos previamente administrados, no dependencia del estado inmunitario del paciente y su relación con la gravedad de la neumonía en el caso de positividad en sangre.
Sin embargo, una serie de inconvenientes: posibilidad de persistencia de los antígenos largo tiempo (semanas o meses) en sangre y en orina, así como los problemas de su especificidad en su determinación en esputo por la presencia de antígenos de neumococo no infectantes en la orofaringe (20% en sanos) y por la posibilidad de reacciones cruzadas con H. influenzae y otros, ha hecho que su uso no esté generalizado.
Los tests de detección de antígenos neumocócicos en orina y en sangre se han considerado tradicionalmente como de baja sensibilidad9. Recientes estudios han puesto de manifiesto la utilidad de la búsqueda de estos antígenos en líquido pleural10.
2.Antígeno de Legionella pneumophila. La DFA en el esputo, es un test rápido, útil incluso a los 2-4 días de haber iniciado el tratamiento antibiótico, con una especificidad elevada, pero con una sensibilidad muy variable (25-75%), estando sólo al alcance de laboratorios experimentados y con un rendimiento que disminuye mucho si no se utilizan anticuerpos monoclonales9. Aumenta a un 80% si esta técnica se asocia al cultivo (difícil, rango de sensibilidad que oscila entre el 11-80%) o si se procesan otras secreciones respiratorias.
El 80% de los pacientes excretan antígeno de Legionella por orina. El método más eficaz de detección parece ser el ELISA policlonal, con una especificidad del 100% y una sensibilidad > 80%, aunque sólo detecta la Legionella pneumophila serotipo 1, la más frecuente. Dado que el antígeno es capaz de persistir un tiempo en la orina, puede falsear el diagnóstico en los casos de recaídas. No obstante las ventajas superan a los inconvenientes.
3.Otros antígenos. Existen tests para la detección de otros antígenos de algunos gérmenes respiratorios:
M. pneumoniae, germen de cultivo lento y en medios especiales, se determina en secreciones respiratorias mediante antisuero policlonal, demostrándose una baja especificidad, ya que muchos individuos son portadores sanos. La técnica de EIA, demostró una sensibilidad del 40-80% y una especificidad del 60-100% dependiendo del método utilizado como referencia (cultivo/serología).
H. influenzae, aunque en el mercado existen métodos para su detección en esputo, suero y orina no mantiene una buena relación coste/beneficio.
C. pneumoniae, aunque su diagnóstico se basa en el cultivo, se ha desarrollado recientemente un test de ID. La experiencia de algunos autores cifra la sensibilidad en un 20% con una especificidad cercana al 90%.
Detección de antígenos víricos
Los cultivos son algo tardíos (entre 5-7 días), es por ello que se han desarrollado diferentes métodos, para la detección de antígenos víricos, fundamentalmente para el VRS, CMV y virus influenza A. Para el primero de ellos se utiliza la IFD, efectuada en aspirado nasotraqueal y con una sensibilidad que varía entre el 75-85%. Para el CMV, podemos detectar los antígenos precoces en unas 16horas, mediante anticuerpos monoclonales, alcanzando una sensibilidad del 93%.
Detección de antígenos para Pneumocystis carinii
Las tinciones citoquímicas tradicionales, aunque, mantienen una alta rentabilidad, requieren mucho tiempo, siendo ésta la razón por la cual se han desarrollado técnicas de tinciones inmunológicas con anticuerpos monoclonales (3 F6) tanto para las muestras obtenidas por LBA como por el esputo inducido. La sensibilidad de la IFD es del 95 %11.
Tests serológicos
Habitualmente no son de utilidad para el diagnóstico etiológico en su fase inicial, aunque sí pueden aportar información retrospectiva, de interés epidemiológico12. Las técnicas clásicas incluyen la obtención de dos muestras de sueros, el primero en la fase aguda y el segundo, semanas después. El aumento durante la convalecencia de la tasa de anticuerpos a concentraciones cuatro veces superiores a las del inicio de la enfermedad, orienta el diagnóstico etiológico en casos de neumonía atípica, por M. pneumoniae, Coxiella, Legionella o Chlamydia.
La detección de anticuerpos inmunofluorescentes (IFA) el ELISA y la microaglutinación son las técnicas más habituales en lo referente al diagnóstico rápido de la Legionella pneumophila. El tiempo para la seroconversión oscila entre las 4-8 semanas. Hay que tener en cuenta que casi el 30 % de los casos con infección aguda por este germen no muestran un aumento de los anticuerpos. Se atribuye al test de IA una sensibilidad de alrededor del 85 % y una especificidad del 95 % cuando se determinan tanto IgG como IgM13.
En los casos de infección por Mycoplasma pneumoniae, la determinación de la fijación de complemento es la técnica clásicamente utilizada. Si se dispone de una determinación en fase de convalecencia, con un título $ 1:64 se considera de alta sospecha. La fijación del complemento tiene una sensibilidad variable con cifras que oscilan entre el 50 y el 90%. Más interesante es el uso de un ELISA para la detección de IgM específica, puesto que aparece en los primeros días de la enfermedad, siendo capaz de diagnosticar el 75 % de los pacientes en los 10 primeros días del comienzo de los síntomas, en una serie de niños con neumonía por M. pneumoniae. No obstante dado que la respuesta IgM, se produce en la primoinfección, es de escasa utilidad en las reinfecciones, en las que se desencadena directamente una respuesta IgG. Los títulos de IgM pueden persistir durante mucho tiempo después de la fase aguda, coincidiendo con la elevación de las cifras de IgG, datos a tener en cuenta para el diagnóstico de M. pneumoniae, Coxiella, Legionella o Chlamydias. Como resumen, podemos decir que no disponemos por el momento, salvo excepciones, de tests serológicos que sirvan de orientación fiable para el tratamiento de las infecciones agudas debidas a estos gérmenes. El EIA, es considerado como el más seguro, permitiendo la titulación de IgG e IgM con una sensibilidad del 92 % y una especificidad del 95 % y un tiempo de seroconversión entre las 3 y las 8 semanas.
Para identificar Chlamydia pneumoniae, se había utilizado la fijación del complemento, aunque no permite diferenciar anticuerposde C. Psittaci, trachomatis o pneumoniae. Actualmente el "gold standard test" es la microinmunofluorescencia, con una elevada sensibilidad y especificidad al compararlo con el cultivo, permitiendo la identificación de las fracciones específicas de IgG, IgM e IgA en suero. La seroconversión tarda entre 3-6 semanas. Más recientemente se han puesto en marcha otros tests serológicos como el EIA, que permite la determinación de anticuerpos IgG específicos con una buena sensibilidad y especificidad.
Para Mycobacterium tuberculosis, es un campo ampliamente prometedor, sobre todo en las formas de tuberculosis infantil, que no acostumbran a ser bacilíferas. Intenta la identificación y cuantificación de anticuerpos específicos para los antígenos del M. tuberculosis o bien la detección de antígenos bacilares en muestras orgánicas utilizando anticuerpos.
Actualmente, se desconoce cuál es la dinámica de la aparición y vida media de las inmunoglobulinas, así como los antígenos de mayor utilidad en el curso de la tuberculosis. Desconocemos también por qué pacientes con formas activas de la enfermedad no tienen en el momento de su diagnóstico, concentraciones detectables de anticuerpos. La cuantificación de anticuerpos IgG e IgM, no ha sido capaz de diferenciar la tuberculosis activa de la residual. La técnica de ELISA (enzimoinmunoanálisis), rápida, con resultados reproducibles y buenas sensibilidades, es la que por el momento parece ofrecer unas mejores perspectivas. No obstante, por el momento no es un sistema que pueda utilizarse para uso general14.
En lo referente a los virus, disponemos de algunos tests, siendo el más utilizado el CFA.
Amplificación enzimática del ADN, mediante la reacción en cadena de la polimerasa (PCR)
La aplicación clínica de esta técnica, se inició al principio de los años ochenta, con el diseño de las técnicas de hibridación con sondas de ADN específico para la detección e identificación de ciertos agentes patógenos. Con la reacción en cadena de la polimerasa (PCR), se consigue la multiplicación de fragmentos concretos de genoma o lo que es lo mismo, un aumento exponencial en el número de cadenas de un segmento de ADN específico.
Esta técnica consta de tres etapas diferenciadas: extracción del ADN, amplificación y análisis del producto final. Tiene una elevada sensibilidad y proporciona resultados de forma precoz en el contexto de un cuadro infeccioso, facilitando los resultados en unas pocas horas no estando condicionados por la administración previamente de antibióticos. Hemos de tener en cuenta unos aspectos importantes: 1)no es polivalente como los son los cultivos, sino que por el contrario es específica para cada especie que se investiga; 2)su elevada sensibilidad proporciona falsos positivos ante pacientes no infectados sino colonizados, y 3)así mismo no es extraña la presencia de falsos negativos, debidos a la presencia de sustancias que pueden actuar como inhibidores de la reacción.
Las muestras con mayor índice de rentabilidad son las que obtenemos directamente del pulmón, mediante técnicas invasivas, aunque este hecho constituye por sí solo un hándicap importante, ya que exigen un material especial, un personal adiestrado y no están exentas de riesgos. La obtenidas directamente del torrente circulatorio, presentan muy baja posibilidad de contaminación por gérmenes colonizantes, son fáciles de conseguir en todos los pacientes y con un bajo índice de riesgo.
Existen dos sistemas: el Amplicor TB (Roche Diagnostic Systems) que amplifica por PCR un fragmento del gen que codifica el ARN ribosómico 16 S, con posterior detección del producto amplificado por una reacción colorimétrica y el sistema GEN-Probe-Amplified MTD, que amplifica el ARNr 23 S mediante la síntesis de ADNc y ARN, utilizando una mezcla enzimática de transcriptasa inversa y ARN polimerasa. Este último no requiere unas instalaciones sofisticadas, utilizable en la mayoría de los laboratorios y con una sensibilidad superior al cultivo y muy buena especificidad. La PCR es altamente específica y sensible en los casos en que los cultivos y la tinción tienen una baja sensibilidad (LBA, TBC miliar o muestras mal obtenidas) es decir, cuando se dan falsos negativos.
Su muy elevada sensibilidad, comporta que una mínima contaminación de la muestra con una sola copia de la secuencia a ampliar, pueda dar falsos positivos.
Para el S. pneumoniae, constituye una prueba en fase experimental. Los trabajos de Gillespie15 desarrollaron una técnica para la detección de una porción del gen de la autolisina 1lytA. Al compararla con el cultivo de esputo y la antigenemia, los autores encontraron una sensibilidad del 93 % y una especificidad del 100 % con un valor predictivo positivo del 100 % y negativo del 95 %. Otros autores16, han efectuado con buenos resultados, estudios basados en la amplificación de fragmentos del gen de la neumolisina.
Por lo que respecta al H. influenzae, la prueba tiene una elevada positividad cuando se efectúa sobre cultivos sanguíneos17.
Para la L. pneumophila, también se ha demostrado una sensibilidad aplicada a muestras de sangre y orina de cerca del 75 %, cuando se realiza en muestras extraídas en los cuatro primeros días del inicio de los síntomas18.
Se han desarrollado sondas de ADN-ARN que demuestran una elevada sensibilidad pero una baja especificidad en muestras faríngeas. La PCR parece ser adecuada para la detección de este germen.
En los pacientes sometidos a trasplante pulmonar, la detección rápida de las infecciones por CMV, permite iniciar con rapidez el tratamiento específico. La utilización de la PCR del ADN en las células del LBA, es apropiado para ladetección rápida y fiable del CMV19.
Estudios microbiológicos
El aislamiento rápido y la identificación valorable de un germen integra el estudio de los procesos infecciosos. En los casos de neumonía comunitaria, podemos conseguir unas cifras de hemocultivos positivos que oscilan entre el 5 y el 20%, contempladas globalmente. En los casos de S.pneumoniae, las cifras se elevan al 30 %.
Tinción de Gram. La valoración del Gram, debe hacerse tanto en función de la presencia de células que indican la procedencia y calidad de la muestra, como del tipo de flora y de sus características. Ante el neumococo, la mayoría de los estudios señalan para el Gram una sensibilidad del 50-60 % y una especificidad del 80 %.
Cultivo de esputo. El crecimiento de un germen, no indica necesariamente una infección por éste. Se interpreta en función de los hallazgos de la tinción de Gram.
El cultivo de micobacterias, previa digestión de restos orgánicos y descontaminación de la flora comensal, debe efectuarse con todas las muestras sospechosas de contener bacilos. Los cultivos son mucho más sensibles, permitiendo la detección en muestras con muy pocas bacterias (10/ml). Los métodos más utilizados son el medio de cultivo clásico sólido Löwenstein-Jensen y los semisintéticos con agar 7 H10 y 7H 11de Middlebrook. Con cualquiera de los métodos, el retraso en la emisión de resultados no es inferior a las 4-6 semanas.
Es por ello, que se han ideado nuevas técnicas que permitan acortar este tiempo; los métodos radiométricos (sistema BACTEC), los medios de cultivo bifásico (MB_Septi-Check) y técnicas especiales para hemocultivo. El primero de ellos, el sistema BACTEC, basado en la medición de la cantidad de 14 CO2 producido por la metabolización de sustratos marcados con carbono-14, que acorta el tiempo a 15-20 días (1semana en muestras con un número importante de bacilos) y con una mayor sensibilidad. Su principal inconveniente es la necesidad de permisos especiales para la manipulación de estas sustancias. El sistema MB-Seti-Check no utiliza isótopos radiactivos, parece tener una sensibilidad mayor, aunque la detección del crecimiento es algo más lenta.
Cultivo del líquido pleural. El aislamiento de un germen en esta cavidad, habitualmente estéril, se considera diagnóstico de certeza. Debe efectuarse una tinción y cultivo si bien esta muestra puede utilizarse para otras técnicas de mayor sensibilidad como la PCR, ADA, antígenos, etc.
Hemocultivo. Es aconsejable efectuarlo en dos ocasiones durante el período febril, a ser posible antes del tratamiento antibiótico y en lugares diferentes. Es una técnica de baja sensibilidad, aproximadamente entre un 10 y un 30%.
Para las micobacterias, las técnicas de hemocultivo (lisis-centrifugación y radiométricas), están indicadas sobre todo en pacientes con sida y cifras de Cd4 inferiores a 50, con una sensibilidad similar en ambas.
La utilización conjunta de métodos antiguos y de los más novedosos basados en la detección de antígenos y ácidos nucleicos permiten conseguir el diagnóstico de las neumonías con una mayor facilidad y seguridad. El futuro inmediato en el campo del diagnóstico dependerá que los laboratorios líderes en el sector puedan poner en nuestras manos una técnica de amplificación automatizada de alto rendimiento, que sea capaz de detectar no sólo M. tuberculosis sino también los principales agentes patógenos respiratorios en la misma muestra clínica, a un precio relativamente bajo.