La neumonía adquirida en la comunidad (NAC) en la edad pediátrica ha sufrido, en la última década, una serie de cambios epidemiológicos, clínicos, etiológicos y de resistencias a antibióticos, que obligan a replantear su abordaje terapéutico. En este documento, dos de las principales sociedades de especialidades pediátricas involucradas en el diagnóstico y tratamiento de esta entidad, como son la Sociedad Española de Infectología Pediátrica y la Sociedad Española de Neumología Pediátrica, así como el Comité Asesor de Vacunas de la AEP, proponen unas pautas consensuadas de tratamiento y prevención, con el fin de proporcionar a todos los pediatras una guía actualizada. En esta primera parte del consenso, se aborda el tratamiento de los pacientes sin enfermedades de base relevantes con NAC que no precisan ingreso hospitalario, así como la prevención global de esta patología con vacunas. En un siguiente documento se expondrá el abordaje terapéutico tanto de aquellos pacientes en situaciones especiales como de las formas complicadas de la enfermedad.
There have been significant changes in community acquired pneumonia (CAP) in children in the last decade. These changes relate to epidemiology and clinical presentation. Resistance to antibiotics is also a changing issue. These all have to be considered when treating CAP. In this document, two of the main Spanish pediatric societies involved in the treatment of CAP in children, propose a consensus concerning therapeutic approach. These societies are the Spanish Society of Paediatric Infectious Diseases and the Spanish Society of Paediatric Chest Diseases. The Advisory Committee on Vaccines of the Spanish Association of Paediatrics (CAV-AEP) has also been involved in the prevention of CAP. An attempt is made to provide up-to-date guidelines to all paediatricians. The first part of the statement presents the approach to ambulatory, previously healthy children. We also review the prevention with currently available vaccines. In a next second part, special situations and complicated forms will be addressed.
La neumonía adquirida en la comunidad (NAC) constituye la principal causa individual de mortalidad infantil en todo el mundo. Se calcula que provoca 1,2 millones de fallecimientos anuales en niños menores de 5 años, lo que supone el 18% de todas las muertes a esta edad, ocurriendo el 99% en países con pocos recursos1.
En países desarrollados, como los de Norteamérica, Europa, Oceanía y en Japón, se estima que suceden hasta 2,6 millones de casos anuales de NAC en niños menores de 5 años, causando 1,5 millones de hospitalizaciones y, aproximadamente, 3.000 muertes por esta causa2, cifra superior a los fallecimientos por meningitis.
La etiología, la presentación clínica y la evolución de la NAC en la edad pediátrica han sufrido, en la última década, una serie de variaciones importantes relacionadas con la introducción de vacunas frente a patógenos involucrados en su etiología (como Haemophilus influenzae [H. influenzae] tipo b y Streptococcus pneumoniae [S. pneumoniae]), el mejor uso de los antibióticos, así como con otros factores aún no explicados y, probablemente, asociados a tendencias epidemiológicas independientes.
Como ya se expuso en el documento sobre etiología y diagnóstico de la NAC consensuado por estas 2 sociedades pediátricas3, los principales agentes etiológicos son los virus y S. pneumoniae. Los primeros afectan, sobre todo, a niños menores de 4-5 años y el segundo a niños de cualquier edad. Sin embargo, en los últimos 10-15 años se ha venido observando una tendencia creciente, superior a la descrita previamente, en la incidencia de neumonías complicadas, tanto con derrame pleural como de formas necrosantes. Esta tendencia se une a un ligero desplazamiento de la edad de aparición de estas formas complicadas. Previamente, era más frecuente en menores de 2-3 años, pero en los últimos años predominan en niños entre los 2 y 5 años. También se ha observado un ligero ascenso de casos provocados por Staphylococcus aureus (S. aureus), en ocasiones algunos por cepas productoras de ciertos factores de virulencia que les confiere una mayor gravedad.
Es un hecho patente la gran variabilidad de tratamientos utilizados por los pediatras que atienden a niños con NAC4 y el mejorable seguimiento de las guías clínicas publicadas en diferentes países5,6. Por ello, uno de los objetivos más ambiciosos de este consenso es homogeneizar las medidas terapéuticas frente a esta enfermedad en nuestro medio, con el fin de mejorar su control, como ya ha sido demostrado previamente7. En este documento, basado en la información científica disponible y en la experiencia de los autores, se proponen las medidas iniciales, que creemos son las más adecuadas, para el abordaje terapéutico de la NAC. Se recogen también las medidas preventivas disponibles frente a la NAC en la población infantil. En otro documento, que se publicará próximamente en esta misma revista, se expondrá el abordaje terapéutico de los casos complicados y en situaciones especiales.
Estado actual de las resistencias a antimicrobianosLas bacterias potencialmente productoras de NAC que presentan problemas de resistencia a antimicrobianos son: S. pneumoniae, S. aureus, Streptococcus pyogenes (S. pyogenes) y H. influenzae tipo b. En nuestro medio, el resto de agentes, los productores de NAC atípica, como Mycoplasma pneumoniae (M. pneumoniae) o Chlamydophila pneumoniae (C. pneumoniae), o los virus, no presentan problemas de este tipo. M. pneumoniae y C. pneumoniae son, habitualmente, sensibles a macrólidos y el único virus susceptible de ser tratado con antivirales, el virus de la gripe, hasta ahora no presenta resistencias a oseltamivir en nuestro medio.
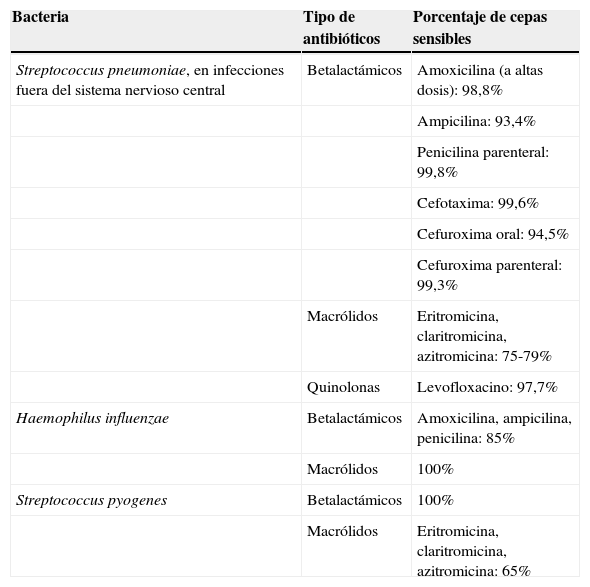
Los datos más fiables sobre las resistencias de los principales patógenos respiratorios en nuestro medio son periódicamente aportados por el estudio multicéntrico conocido como proyecto Sensibilidad a los Antibióticos Usados en la Comunidad en España (SAUCE). El último, publicado en 2010 como estudio SAUCE-48, ofrece resultados de sensibilidad y resistencia según unos puntos de corte oficiales (CLSI breakpoints). Reúne un total de 2.559 aislamientos de S. pneumoniae, 2.287 de S. pyogenes y 2.287 de H. influenzae, y se comparan con los registrados en los 11 años previos. De forma resumida, los datos más importantes se describen en la tabla 18. Para S. pneumoniae, en cuanto a la sensibilidad a betalactámicos, en la actualidad, la práctica totalidad de las cepas circulantes en España son sensibles a amoxicilina por vía oral y a la penicilina y ampicilina por vía intravenosa, y, por consiguiente, también a la cefuroxima, si se desea ampliar el espectro. Todas son también sensibles a cefotaxima. En los últimos años, las cepas no susceptibles a penicilina (sensibilidad intermedia o resistencia alta) han pasado del 60,0 al 22,9%. La proporción de cepas con resistencia alta a penicilina oral (CMI ≥ 2) han descendido drásticamente del 36,5 al 0,9%. Además, el 0% presenta resistencia alta (CMI ≥ 8) para la penicilina parenteral y solo el 0,2% sensibilidad intermedia (CMI ≥ 4). Siguen existiendo unas tasas altas de resistencia a macrólidos (21-25%).
Datos de sensibilidad de los principales bacterias causantes de NAC en nuestro medio (datos procedentes del Estudio SAUCE-4)
| Bacteria | Tipo de antibióticos | Porcentaje de cepas sensibles |
|---|---|---|
| Streptococcus pneumoniae, en infecciones fuera del sistema nervioso central | Betalactámicos | Amoxicilina (a altas dosis): 98,8% |
| Ampicilina: 93,4% | ||
| Penicilina parenteral: 99,8% | ||
| Cefotaxima: 99,6% | ||
| Cefuroxima oral: 94,5% | ||
| Cefuroxima parenteral: 99,3% | ||
| Macrólidos | Eritromicina, claritromicina, azitromicina: 75-79% | |
| Quinolonas | Levofloxacino: 97,7% | |
| Haemophilus influenzae | Betalactámicos | Amoxicilina, ampicilina, penicilina: 85% |
| Macrólidos | 100% | |
| Streptococcus pyogenes | Betalactámicos | 100% |
| Macrólidos | Eritromicina, claritromicina, azitromicina: 65% |
Tomado de Pérez-Trallero et al.8
Para H. influenzae, el 15,7% son productores de betalactamasas y, por tanto, resistentes a penicilina, ampicilina o amoxicilina. Este porcentaje ha descendido, ya que el previo era del 25,7%.
Estos datos, basados en muestras procedentes de niños y adultos de hace 6-7 años, son prácticamente superponibles a los recientemente extraídos del estudio Heracles en la Comunidad de Madrid (mayo del 2011-abril del 2013)9,10, donde el 100% de las cepas de S. pneumoniae aisladas en niños menores de 15 años con enfermedad neumocócica invasora fuera del sistema nervioso central —incluyendo neumonías bacteriémicas y empiemas— son sensibles a penicilina y cefotaxima.
Tratamiento adyuvante de soporteEl niño con NAC, además de la terapia antibiótica, puede precisar tratamiento de soporte, siendo menor en el paciente que no precisa ingreso hospitalario.
Los niños con neumonía suelen tener dolor asociado (pleurítico, abdominal, cefalea) y molestias o dolor debido a la inflamación de las vías aéreas superiores (otalgia, odinofagia). Se recomienda analgesia para su alivio, especialmente en caso de dolor pleurítico, pues interfiere con la tos y la respiración11,12. Se puede utilizar paracetamol (15mg/kg/6h; hasta un máximo de 75mg/kg/día) o ibuprofeno (5-10mg/kg/6-8h). La fiebre debe ser controlada con estos mismos agentes, puesto que aumenta el consumo de oxígeno. No hay suficientes estudios que apoyen que los mucolíticos y los antitusígenos sean beneficiosos, y de forma teórica se recomienda que se eviten las medicaciones con codeína o con antihistamínicos en los niños pequeños13.
El trabajo respiratorio y la fiebre aumentan los requerimientos de líquidos. El modo ideal de aportarlos es por vía oral, en pequeñas cantidades y de forma frecuente.
Tratamiento antibiótico ambulatorio de la neumonía adquirida en la comunidad no complicadaIndicación para el empleo de antibióticosEl tratamiento etiológico empírico de la NAC se establece en función de los patógenos más frecuentemente implicados. Sin embargo, uno de los problemas más importantes es la correcta distinción entre los casos de probable etiología viral y los de probable etiología bacteriana. Se tiende erróneamente al uso (y abuso) de los antibióticos, actitud que conduce a un aumento de las resistencias antimicrobianas. Una edad inferior a 2 años, manifestaciones clínicas leves de vías respiratorias inferiores y el antecedente de una inmunización correcta para su edad frente a H. influenzae tipo b y S. pneumoniae son datos que disminuyen la probabilidad de etiología bacteriana14.
Los antibióticos están indicados en los casos de NAC típica, en los que se sospeche etiología bacteriana. En los casos de NAC atípica, solo se emplearán en mayores de 4-5 años y en ciertos pacientes de menor edad, sobre todo si tienen cierta gravedad.
Para el tratamiento en situaciones especiales (alérgicos a betalactámicos, enfermedad de base, inmunodeprimidos, etc.), o para pacientes que precisan hospitalización, se remite al lector al documento específico que se publicará en otro número posterior de esta misma revista.
Elección del antibiótico, ruta, dosificación y duraciónNeumonía adquirida en la comunidad típicaSi se decidiera iniciar tratamiento antibiótico ambulatorio en una NAC típica sin criterios de ingreso hospitalario, teniendo en cuenta que la mayoría son causadas por neumococo y que, actualmente, casi todos ellos son sensibles a penicilina y amoxicilina8, el antibiótico de elección es la amoxicilina por vía oral, a dosis de 80-90mg/kg/día, cada 8 h (tabla 2). Esta recomendación coincide con la de las guías internacionales actuales12,15. La dosis máxima recomendada, según la ficha técnica, es de 2 g cada 8 h, dada la buena tolerancia de este antibiótico.
Tratamiento antibiótico ambulatorio del niño con NAC que no precisa hospitalización
| NAC típica (con etiología neumocócica sospechada o confirmada) | ||
|---|---|---|
| Nombre | Posología | Duración habitual |
| Amoxicilina por vía oral | 80-90mg/kg/día, repartido en 3 dosis (cada 8 h)a | 7 días |
| NAC atípica con etiología confirmada o con alta sospecha de Mycoplasma o Chlamydia. Macrólidos más empleados | ||
|---|---|---|
| Nombre | Posología | Duración |
| Azitromicina por vía oral | 10 mg/kg cada 24 h (dosis máxima: 500 mg/día)b | 3 días |
| Claritromicina por vía oral | 15mg/kg/día, cada 12 h (dosis maxima: 1 gramo/día) | 7 días |
Puede existir cierta discusión en cuanto a la dosis comentada. Dada la adecuada absorción de este fármaco y su buena penetración a nivel pulmonar, así como las bajas tasas de resistencias de S. pneumoniae, podrían ser suficientes dosis de 40-50mg/kg/día en la mayoría de los casos. Este consenso recomienda, sin embargo, dosis altas (80-90mg/kg/día) por las siguientes razones16:
- –
El empleo de dosis bajas (40-50mg/kg/día) puede favorecer la reaparición de cepas resistentes.
- –
Los niños con infecciones respiratorias presentan vómitos con frecuencia, lo que podría provocar situaciones de infradosificación, sobre todo si se emplean dosis bajas.
- –
En las infecciones neumocócicas de vías altas (otitis media aguda y sinusitis), es necesario seguir empleando dosis altas por las dificultades de penetración de los fármacos en estas localizaciones. Es preferible homogenizar la dosificación de este antibiótico oral para todas las infecciones neumocócicas, con el fin de disminuir los errores de prescripción.
El empleo de ácido clavulánico junto a amoxicilina en el niño con NAC típica, sin enfermedad de base y bien vacunado frente a H. influenzae tipo b, no está justificado si se piensa en una probable etiología neumocócica, ya que las resistencias de S. pneumoniae no asientan en la producción de betalactamasas. Además, su utilización se asocia, con relativa frecuencia, a sintomatología gastrointestinal, sobre todo diarrea, que puede disminuir la absorción de la amoxicilina.
Los macrólidos no deben emplearse para el tratamiento de la NAC con características típicas, por múltiples motivos, entre los que destacan las resistencias actuales del S. pneumoniae a estos antibióticos y el riesgo de bacteriemia en estos pacientes17. A pesar de ello, su utilización incorrecta en estos procesos es frecuente5.
La duración recomendada del tratamiento en un paciente con NAC típica sin complicaciones y que no precise ingreso es de 7 días. Existen diversos metaanálisis, basados fundamentalmente en ensayos realizados en países con recursos escasos, en los que se concluye que 3 días de amoxicilina por vía oral son suficientes como tratamiento ambulatorio en niños de 2 a 59 meses con NAC. Esta estrategia, aunque reduce costes18,19, se asocia a una tasa apreciable de fallos terapéuticos, por lo que no debe aplicarse en nuestro medio.
Neumonía adquirida en la comunidad atípicaEn el caso de NAC atípica, en menores de 4-5 años, habitualmente la etiología va a ser viral, por lo que no se prescribirán antibióticos. En mayores de 4-5 años, donde la etiología por M. pneumoniae es más frecuente (hasta el 40% de las NAC en este grupo etario)20 y, en menor medida, por C. pneumoniae, se recomienda el empleo de macrólidos por vía oral15,20, aunque no existe evidencia clara de su rendimiento en la curación clínica de esta enfermedad en niños21,22.
Los macrólidos más empleados actualmente (azitromicina y claritromicina) y su posología se describen en la tabla 215. La eritromicina está claramente en desuso por sus efectos adversos (gastrointestinales fundamentalmente) y complicada posología (cada 6 h, 10-14 días), que dificultan un cumplimiento terapéutico adecuado.
Evolución y seguimientoUna vez diagnosticada la NAC e iniciado el tratamiento, se recomienda una valoración clínica por parte del pediatra a las 48 h. En los casos no complicados, el 90% de los pacientes queda afebril a las 48-72 h de iniciar el tratamiento antibiótico, no precisando posteriores controles analíticos ni radiológicos3.
Solo una pequeña proporción necesita ingreso hospitalario. El abordaje del fracaso terapéutico y la valoración del ingreso hospitalario se tratarán en la segunda parte de este documento.
Medidas preventivas. VacunasLa vacunación frente a ciertos microorganismos ha demostrado tener impacto en la incidencia y mortalidad de la NAC a nivel mundial. Los agentes etiológicos para los que hay vacunas disponibles son S. pneumoniae, H. influenzae tipo b y el virus de la gripe.
Vacunación frente a Streptococcus pneumoniaeLa comercialización de la vacuna conjugada heptavalente se acompañó de una reducción global de la enfermedad neumocócica invasiva (ENI) en niños, dado su efecto sobre la colonización nasofaríngea por los serotipos incluidos en la vacuna y, consecuentemente, en sus formas clínicas23. Sin embargo, en los últimos años se produjo un auge de la enfermedad, fundamentalmente de las NAC complicadas, sobre todo en los niños mayores de 2 años24, producidas por serotipos no incluidos en la vacuna23. En España, los más frecuentes son: 1, 19A, 7F, 3, 6A, 19F. El serotipo 1 afecta preferentemente a niños mayores de 24 meses de edad y causa, sobre todo, neumonía bacteriémica y empiema pleural. El 85% de los empiemas pleurales de los niños en España estaba producido por los serotipos 1, 19A y 3, antes de la llegada de las nuevas vacunas, según un estudio realizado por el Laboratorio Español de Referencia de Neumococo del Instituto Carlos III25. La mayoría de los serotipos comentados son uniformemente sensibles a penicilina, excepto el serotipo 19A, que se asocia con cierta frecuencia a resistencias, incluida la cefotaxima.
Actualmente, hay 2 vacunas conjugadas antineumocócicas autorizadas en niños: la vacuna decavalente (VNC10) (Synflorix®, GSK), hasta los 5 años de edad, y la tridecavalente (VNC13) (Prevenar 13®, Pfizer), autorizada en niños hasta los 17 años. La vacunación antineumocócica sistemática sigue siendo recomendada por el Comité Asesor de Vacunas de la Asociación Española de Pediatría en su propuesta anual de inmunizaciones26.
Vacuna antineumocócica conjugada 13-valenteLa VNC13 contiene los 7 serotipos de la VNC7 y los 6 serotipos adicionales siguientes: 1, 3, 5, 6A, 7F y 19A, y cuenta con la aprobación para prevención de NAC. Actualmente, la VNC13 ofrece la cobertura más amplia frente a la enfermedad neumocócica a nivel universal23, incluido nuestro medio9,10,25, y por tanto, es la recomendada para todos los niños menores de 5 años, tanto sanos como con enfermedades de riesgo27.
En Madrid, a partir de julio del 2012, la VNC13ha dejado de ser financiada, por lo que la cobertura ha descendido al 70% aproximadamente. Aun así, los datos siguen siendo muy buenos por ahora, con descensos de la NAC bacteriémica (87%), del empiema pleural neumocócico (61%) y de la meningitis (72%), respecto al periodo 2007-20109.
En el Reino Unido, al cabo de un año de iniciar la vacunación, la eficacia de la VCN13 frente a los serotipos adicionales (1, 3, 5, 6A, 7F y 19A) ha sido mayor del 50% en niños menores de 2 años28.
En Francia, donde se vacuna de forma sistemática con VNC13 desde 2010 (previamente con VNC7), existen datos recientes sobre la reducción de la NAC en niños menores de 15 años, que es del 16% en las NAC globales, y del 63% en las neumocócicas. A ello se suma un descenso del 53% para los casos con derrame pleural29.
En los EE. UU., con vacunación sistemática con VNC13 desde 2010 (previamente con VNC7), no solo se ha observado una disminución de más del 50% de los casos de ENI por cualquier serotipo y del 70% de los casos producidos por los serotipos de la VNC1330, sino que, en el año 2012 se ha apreciado también un descenso del 65% de las hospitalizaciones por NAC en niños menores de 2 años27.
En Latinoamérica, varios países han publicado buenos resultados de efectividad tras la introducción de la VNC13 en sus calendarios sistemáticos, como Argentina, con una reducción de hasta el 41% de los casos de NAC en menores de 5 años31. En Uruguay, se ha observado un descenso del 78% de las hospitalizaciones por NAC y hasta del 92% en las de etiología neumocócica en niños menores de 14 años32.
Vacuna antineumocócica conjugada 10-valenteLa VNC10, además de los serotipos contenidos en la VNC7, incorpora otros 3 serotipos: el 1, el 5 y el 7F, y está aprobada para la prevención de NAC. En un ensayo clínico aleatorizado (estudio COMPAS), realizado con aproximadamente 24.000 lactantes en 3 países latinoamericanos, se ha observado una eficacia sobre la NAC típica del 22% (IC del 95%, 7,7-34,2)33.
En Brasil, un país con baja incidencia del serotipo 19A, desde la introducción de la vacunación sistemática con VNC10, se ha producido un descenso de la mortalidad por neumonía del 15% en menores de 24 meses34.
Vacuna antineumocócica polisacarídica no conjugada 23-valenteEn cuanto a la vacuna antineumocócica no conjugada de 23 serotipos, se mantiene la recomendación oficial en niños mayores de 2 años con factores de riesgo26, aunque puede que su impacto sobre la prevención de la NAC sea muy discreto.
Vacunación frente a Haemophilus influenzae tipo bDesde la introducción de la vacuna frente a Hib a finales de los años 90, se ha producido una drástica disminución de las NAC por este microorganismo. En algunos trabajos ha llegado a demostrarse una reducción de hasta un 30% de las NAC confirmadas radiológicamente35,36.
Dado que H. influenzae no tipificable representa una causa muy infrecuente de NAC en niños previamente sanos, el impacto de la vacuna VNC10 (por su componente Hi no tipificable) en ellos, no debe ser alto.
Vacunación antigripalEl virus de la gripe es causa per se de NAC en época epidémica. Además, en los casos de NAC bacteriana, la coinfección con este virus se asocia a una mayor incidencia de formas complicadas37, sobre todo en los casos en los que se aísla S. aureus, o no se aísla ningún microorganismo.
La vacunación antigripal se recomienda, según las guías actuales, en pacientes mayores de 6 meses con factores de riesgo de complicaciones, o en sus convivientes38. Actualmente, los preparados habitualmente empleados en niños son trivalentes inactivados para su administración por vía intramuscular. Algunos países, como EE. UU. y Reino Unido, están empleando, en mayores de 2 años sin antecedentes de hiperreactividad bronquial/asma, un preparado con virus vivos atenuados por vía intranasal, que probablemente esté disponible en España para la campaña 2015-2016.
FinanciaciónLos autores declaran que no han recibido ningún tipo de financiación para la elaboración del documento.
Conflicto de interesesConflicto de intereses de los autores con relación al documento (en los últimos 5 años):
- –
DMP ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en un ensayo clínico de Novartis y como consultor en Advisory Board de Astra-Zeneca y Pfizer.
- –
AAM no presenta conflicto de intereses.
- –
ATG ha colaborado en actividades de investigación subvencionadas por Pfizer.
- –
AEM ha colaborado en actividades docentes subvencionadas por Novartis, como investigador en un estudio multicéntrico auspiciado por GlaxoSmithKline y como consultor en un Advisory Board de Gilead.
- –
JFM ha colaborado en actividades docentes subvencionadas por Gilead y Abbvie.
- –
JGG ha colaborado en actividades docentes subvencionadas por Pfizer y Sanofi Pasteur MSD.
- –
AMG ha participado como consultor en Advisory Board de Abbvie y Gilead, ha recibido ayudas de investigación institucional de Abbvie y ayudas para asistencia a congresos de Abbvie, Actelion, Ferrer, GlaxoSmithKline y Novartis.
- –
CRGL ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline y como consultor en Advisory Board de Astra-Zeneca, Novartis, GlaxoSmithKline y Pfizer.
- –
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
- –
JSL ha colaborado como investigador en ensayos clínicos de GlaxoSmithKline y Roche.
Los nombres de los componentes de las diferentes Sociedades son:
- •
Grupo de Trabajo de Infecciones Respiratorias. Sociedad Española de Infectología Pediátrica (SEIP):
Moreno-Pérez D, García García JJ, Rodrigo Gonzalo de Lliria C, Ruiz Contreras J y Saavedra Lozano J.
- •
Sociedad Española de Neumología Pediátrica (SENP):
Andrés Martín A, Escribano Montaner A, Figuerola Mulet J, Moreno-Galdó A
- •
Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP):
Moreno-Pérez D, Ruiz Contreras J