La oclusión aguda mantenida seguida de la reperfusión de la arteria mesentérica superior (AMS) puede desencadenar en pocas horas el daño irreversible del intestino. Nuestro objetivo fue determinar los cambios de flujo mesentérico medidos por ecografía Doppler color y la correlación con las lesiones histológicas en un modelo experimental de isquemia-reperfusión.
Material y métodoSe estudiaron 3 grupos (control, isquemia y reperfusión) de ratas Sprague-Dawley de 17 días de vida. El modelo utilizado fue de isquemia-reperfusión sobre la AMS. Posteriormente, realizamos una ecografía intraabdominal. Las variables ecográficas fueron: velocidad sistólica máxima (VSM), velocidad media (Vm), flujo diastólico (FD) y los índices de pulsatilidad (IP), resistencia (IR) y sístole/diástole (S/D). Las variables histológicas fueron: lesión intestinal (escala Wallace/Keenan y Chiu), morfométricas (altura [AMV] y espesor medio de vellosidades) y células caliciformes. Utilizamos la correlación de Sperman (rs).
ResultadosEn el grupo reperfusión la VSM (74,3cm/s), el IP (7,33) y S/D (25,75) en la AMS se encuentran aumentados respecto a los controles (41,35cm/s [3,12]; [12.45]). La VSM, IP y S/D establecieron regresiones significativas (p < 0,01) con: Wallace/Keenan (rs = 0,655; rs = 0,593; rs = 0,63), Chiu delgado (rs = 0,569; rs = 0,522; rs = 0,47), la AMV (rs = –0,495; rs = –0,452; rs = –0,459), y células caliciformes del colon (rs = –0,525; rs = –0,45; rs = –0,518).
ConclusionesEn la fase de reperfusión el incremento del flujo mesentérico expresado por la VSM y el IP podría pronosticar de forma significativa el potencial daño intestinal que ocurre a nivel macroscópico y microscópico.
Maintained acute occlusion followed by reperfusion of the superior mesenteric artery (SMA) in a few hours can trigger irreversible bowel damage. The aim of the study was to determine the changes in mesenteric flow measured by colour Doppler Ultrasound and correlating with histological lesions in an experimental model of ischaemia-reperfusion.
Method and materialThree groups of Sprague-Dawley 17 day-old rats were studied (control, ischemia and reperfusion). The model used was ischaemia-reperfusion over the SMA. Intra-abdominal ultrasound was then performed. The parameters recorded were: Maximum systolic velocity (MSV), pulsatility index (PI), resistance (RI) and systole-diastole (S/D). The histological variables were: intestinal lesion (Wallace/Keenan-Chiu scale), morphometrics (mean villus height [MVH]), and goblet cells. The Spearman (rs) correlation was used.
ResultsThe MSV in the reperfusion group was 74.3cm/s, the PI 7.33 and S/D 25.75 in the SMA, which were higher than the controls (41.35cm/s; 3.12 and 12.45, respectively). A direct association (P<.01) was found between MSV, PI and S/D regarding: Wallace/Kennan scoring system (rs = 0.655; rs = 0.593; rs = 0.63) and the Chiu (rs = 0.569; rs = 0.522; rs = 0.47). While the correlation was the reverse (P<.01) when associated with the MVH (rs = –0,495; rs = –0,452; rs = –0,459) and goblet cells of the colon (rs = –0,525; rs = –0,45; rs = –0,518).
ConclusionsThe reperfusion phase increased mesenteric flow expressed by the MSV and PI and could significantly predict the potential bowel damage at macroscopic and microscopic level.
Respecto al flujo mesentérico podemos comentar que la fuente principal de irrigación del páncreas, intestino delgado, colon ascendente y transverso es la arteria mesentérica superior (AMS). Es así que una oclusión aguda en su tronco principal puede desencadenar necrosis en pocas horas o la muerte1,2.
En la enterocolitis necrosante (ECN) de etiología multifactorial, una de las causas que se relaciona con la enfermedad es el proceso de isquemia-reperfusión caracterizada por inflamación, lesión y daño del intestino, que progresa hacia la necrosis transmural y perforación3,4.
Optar por un tratamiento médico o quirúrgico en ocasiones es difícil; actualmente en muchos centros se aplican los criterios modificados de Bell5. Creemos que investigar la correlación del flujo mesentérico medido por ecografía Doppler color y el cambio patológico de la lesión intestinal en un modelo animal de isquemia-reperfusión puede ser útil para la toma de decisiones terapéuticas. La ecografía no es una prueba diagnóstica de rutina en la ECN, sin embargo, estudios del flujo mesentérico en neonatos humanos1,6-11 y animales de experimentación12,13 nos aportan algunos criterios aislados del proceso de isquemia-reperfusión como una de las causas de ECN.
Material y métodoSe estudiaron ratas Sprague-Dawley (Harlan Interfauna, Barcelona, España) de 17 días de vida con un peso entre 21 y 36g. Fueron alimentadas con pellet de dieta y agua ad libitum. El experimento fue aprobado por el Comité Ético de Experimentación Animal de la Universidad de Barcelona.
Modelo animalSe aplicó un modelo de isquemia-reperfusión desarrollado por nuestro grupo14. Los animales fueron anestesiados con isoflorano (inhalado), practicando una laparotomía media suprainfraumbilical, se exteriorizó el intestino delgado para proceder al pinzamiento (animales que se reperfundieron) o ligadura con seda circular 6/0 (animales que no se reperfundieron) de los vasos mesentéricos superiores durante 60 min. La oclusión vascular fue confirmada por la pérdida de pulsación en el mesenterio. Durante el tiempo que duró la oclusión, el intestino fue reintroducido en la cavidad abdominal y fue irrigado con suero fisiológico. Tras los 60 min de isquemia se retiró la pinza vascular y se comprobó que la reperfusión que duro 24 h. Se procedió al cierre de la cavidad abdominal en un sólo plano con seda 4/0. Las ratas del grupo reperfusión fueron alimentadas con pellet de dieta y agua ad libitum por 24 h.
Ecografía adaptada al modelo animalSe utilizó un equipo ecográfico Siemens Sonoline Antares™ (Siemens Medical Systems, Malvern, PA, EE. UU.). Se creó un patrón estándar (Abd Freud) validado por el Servicio de Diagnóstico por la Imagen del Hospital Sant Joan de Déu, Barcelona, el mismo que fue almacenado y aplicado en todos animales.
A los 60 min del tiempo de apertura de la cavidad abdominal, 60 min de isquemia y 24 h de reperfusión, se aprovechó la laparotomía media para exteriorizar nuevamente el intestino delgado, aplicar un transductor P10-4 (4-10MHz) intraabdominal y observar en sentido sagital la AMS. En todo momento, se utilizó el color para identificar los vasos. El estudio eco-Doppler color tuvo una duración de 10 min aproximadamente con el fin medir, capturar y almacenar imágenes estáticas y en movimiento del flujo mesentérico. La velocidad y el flujo se registraron en centímetros por segundo (cm/s) y los índices de resistencia medidos fueron: Pourcelot15 (pulsatilidad), Gosling16 (resistencia) y FitzGerald17 (sístole/diástole).
Diseño experimentalGrupo control (n=10]: posterior a la exposición de la cavidad abdominal por 60 min (no isquemia ni reperfusión), se practicaron una ecografía Doppler color intraabdominal y toma de muestras.
Grupo isquemia (n=10): posterior a la isquemia (ligadura) por 60 min, se practicaron ecografía Doppler color intraabdominal y toma de muestras.
Grupo reperfusión (n=16): se realizó isquemia (pinza) y la reperfusión, tal y como se ha descrito en el modelo experimental. Posterior a las 24 h de la reperfusión, se practicó una segunda laparotomía para realizar una ecografía Doppler color intraabdominal y toma de muestras.
En todos los grupos los animales fueron sacrificados al finalizar el estudio.
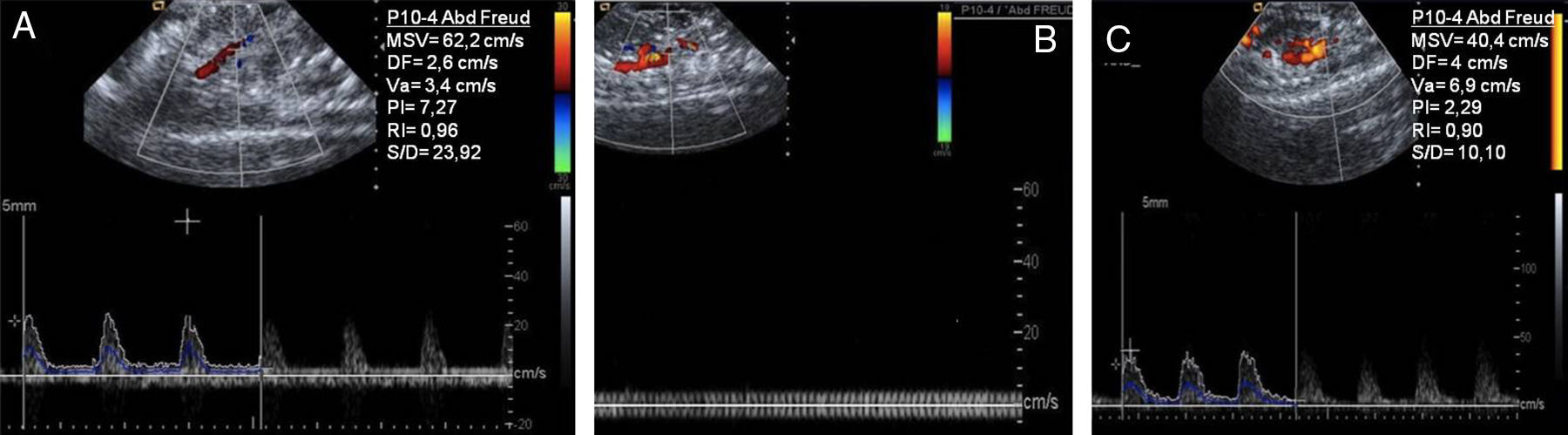
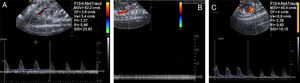
Estudio de ecografía Doppler colorSe colocó el cursor entre la sístole de la primera curva y la diástole de la tercera curva de la AMS, partiendo de que es importante obtener un patrón continuo de 5 curvas como mínimo (fig. 1). Se dibujó automáticamente sobre las 3 ondas marcadas, el recorrido del flujo de los siguientes parámetros: velocidad sistólica media (VSM), flujo diastólico (FD), velocidad media (Vm) y los índices de pulsatilidad (IP), de resistencia (IR) y sístole-diástole (S/D).
Valoración del flujo en la arteria mesentérica superior (AMS). Transductor (4-10MHz) P10-4. A) Grupo control: se observa valores en condiciones normales. B) Grupo isquemia: ausencia de flujo sobre la AMS, no existe registro flujométricos. C) Grupo control: se observa nuevamente un registro flujométrico con un incremento de sus valores.
Macroscópico: la cavidad abdominal fue inspeccionada y se anotó la presencia o no de dilatación intestinal, cambios en la coloración de la serosa, ascitis y/o perforación. Se utilizó un sistema de puntuación macroscópico que va de 0-5, descrito por Wallace y Keenan18: 0 (normal), 1 (hiperemia local sin ulceración), 2 (ulceración sin hiperemia), 3 (ulceración con hiperemia en un punto), 4 (ulceración con hiperemia en 2 o más sitios) y 5 (ulceración que se extiende más de 2cm en varios puntos)
Microscópico: se tomaron muestras a 3cm del íleon distal y 1cm de la ampolla del colon de cada animal. Estas muestras fueron lavadas en phosphate buffered saline, fijadas en formol al 10% durante 24 h, y fueron teñidas con hematoxilina-eosina. El estudio microscópico tuvo un control externo (Servicio de Anatomía Patológica) que desconocía la procedencia de origen de las muestras estudiadas. Las mediciones detalladas a continuación fueron realizadas a una magnificación de 20×/0,40.
El estudio de lesión intestinal (vellosidades) fue puntuado por la escala de Chiu19, la misma que va de 0 a 5, como la describimos a continuación: 0 (normal), 1 (espacio subepitelial de Gruenhagen; congestión capilar), 2 (separación moderada entre el epitelio y la lámina propia), 3 (separación masiva del epitelio que se extiende hacia la base de la vellosidad; algunas vellosidades aparecen denudadas), 4 (denudación de múltiples vellosidades con exposición de la lámina propia y de los capilares dilatados) y 5 (digestión y desintegración de la lámina propia; hemorragia y ulceración).
El estudio morfométrico medido en micras (μm) comprendió la altura media de vellosidades (AMV) y espesor medio de vellosidades (EMV)14. La altura de la vellosidad fue calculada dibujando una línea desde el vértice de la misma hasta su base. El espesor de una vellosidad fue calculado midiendo el ancho de la vellosidad. Además, observamos la arquitectura de la vellosidad (regeneración o atrofia). Estas mediciones expresadas en porcentaje fueron repetidas en al menos el 70% de las vellosidades de cada sección y se calculó la media.
Otros hallazgos histológicos que consideramos analizarlos fueron los siguientes: neumatosis, perforación, hipertrofia glandular, células caliciformes y mitosis20. Se repitió esta valoración en todas las secciones de cada corte en tanto por ciento y se calculó la media.
El estudio descriptivo fue expresado en forma de mediana (rangos). De los resultados significativos a la prueba de Kruskal-Wallis, se realizó la comparación mediante la prueba U de Mann-Whitney y la correlación de rangos de Sperman (rs). Consideramos significativa una p<0,01. Se utilizó el programa SPSS versión 17.
ResultadosCambios del flujo mesentérico por isquemia-reperfusiónSe observó un incremento significativo (fig. 1) en el grupo reperfusión (p<0,01) de la VSM, el IP, el IR y el S/D,) y un descenso de la Vm y el FD.
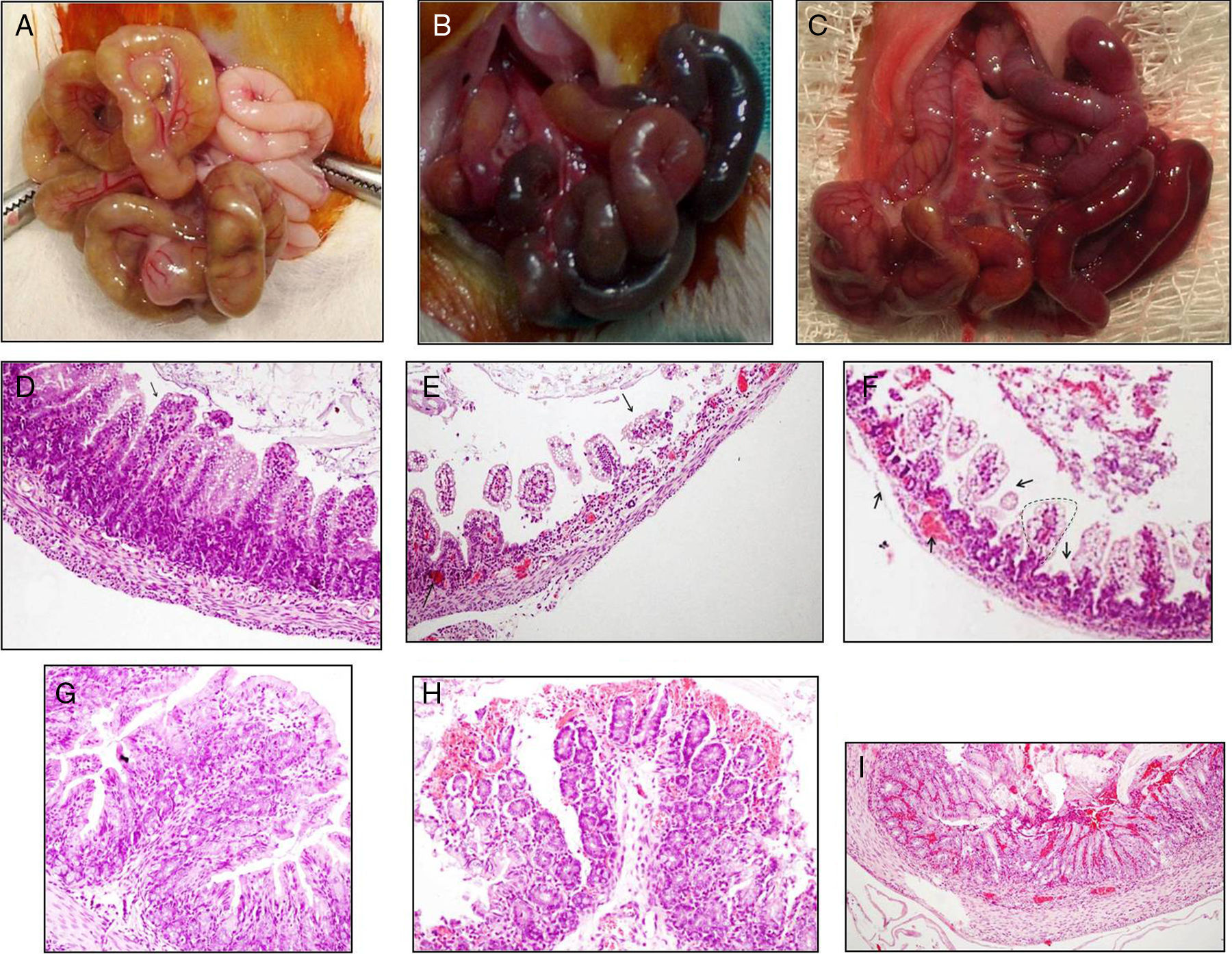
Lesión intestinal macroscópica por isquemia-reperfusiónLas lesiones, según el sistema de puntuación modificado de Wallace y Keenan (p<0,001), para el grupo reperfusión fue 4 (3-5) comparado con 5 del grupo isquemia y con 0 del grupo control (fig. 2A-C). No se encontró ascitis o perforación intestinal.
Lesión intestinal. Puntuación macroscópica de Wallace/Keenan. A) Grupo control (0), ausencia de signos de dilatación o lesión intestinal. B) Grupo isquemia (5), dilatación intestinal y signos importantes de isquemia con zonas de necrosis. C) Grupo reperfusión (4 [3-5]), dilatación intestinal y signos de isquemia. Puntuación microscópica Chiu. D) Mucosa del íleon distal del grupo control (0) en la que se aprecian microvellosidades de características normales (flecha) con conservación de la AMV y EMV. E) Denudación masiva y necrosis más intensa de vellosidades en el íleon distal con zonas más marcadas de atrofia (flecha) en el grupo isquemia (4.46 [4,25-4,67]), además de un acortamiento intenso de la vellosidades. F) Denudación masiva, necrosis y zonas de hemorragia (flecha) de vellosidades en el íleon distal del grupo reperfusión (3 [2,86-3,5]), además de zonas de regeneración (línea punteada) con un acortamiento de la AMV y EMV. G) Mucosa del colon en el grupo control (0) de características normales. H) Mucosa del colon en el grupo isquemia (2,67 [2,33-3,33]), con zonas de hemorragia y necrosis focal. I) Mucosa del colon en el grupo reperfusión (3,1 [2,76-3,6]) con zonas de hemorragia más marcadas (flecha) y necrosis focal transmural.
Los datos se expresan como mediana (rango intercuartil).
p<0,001 frente al grupo control.
p<0,001 frente al grupo isquemia.
En el íleon, la lesión intestinal (fig. 2D-F), puntuada por la escala de Chiu, en el grupo reperfusión mostró alteraciones significativas en la mucosa del intestino delgado en comparación con el grupo control (p<0,001). En todos los animales se apreció desde una separación masiva del espacio de Gruenhagen, denudación y desintegración de las vellosidades, hasta necrosis de la lámina propia, incluyendo en algunos casos necrosis transmural focal. Similares cambios pero de mayor intensidad se apreciaron en el grupo isquemia. En el colon (fig. 2G-I), el estudio microscópico del grupo reperfusión (3,1 [2,76-3,6]) no demostró cambios significativos (p>0,01) en la mucosa respecto al grupo isquemia (2,67 [2,33-3,33]), pero sí mayores diferencias (p<0,001) respecto a los controles (0).
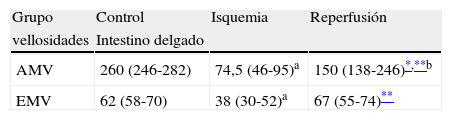
En el intestino delgado, la isquemia y la reperfusión por 24 h (tabla 1) causaron un acortamiento de vellosidades respecto al grupo control (fig. 2D-F). Es así que en el grupo reperfusión la AMV fue de 150 (138-246) comparado con 74,5 (46-95) del grupo isquemia y con 260 (246-282) del grupo control (p<0,001). Respecto al EMV, este parámetro morfométrico también se encontró afectado en los grupos reperfusión e isquemia al compararlo con el grupo control (tabla 1).
Parámetros morfométricos de las vellosidades intestinales. Se observa un acortamiento muy intenso en el grupo isquemia y un acortamiento moderado en el grupo reperfusión al compararlo con el grupo control
| Grupo | Control | Isquemia | Reperfusión |
| vellosidades | Intestino delgado | ||
| AMV | 260 (246-282) | 74,5 (46-95)a | 150 (138-246)*,**b |
| EMV | 62 (58-70) | 38 (30-52)a | 67 (55-74)** |
AMV: altura media de vellosidades (μm); EMV: espesor medio de vellosidades (μm); RI: rango intercuartil I-II.
Los datos son expresados como mediana (RI).
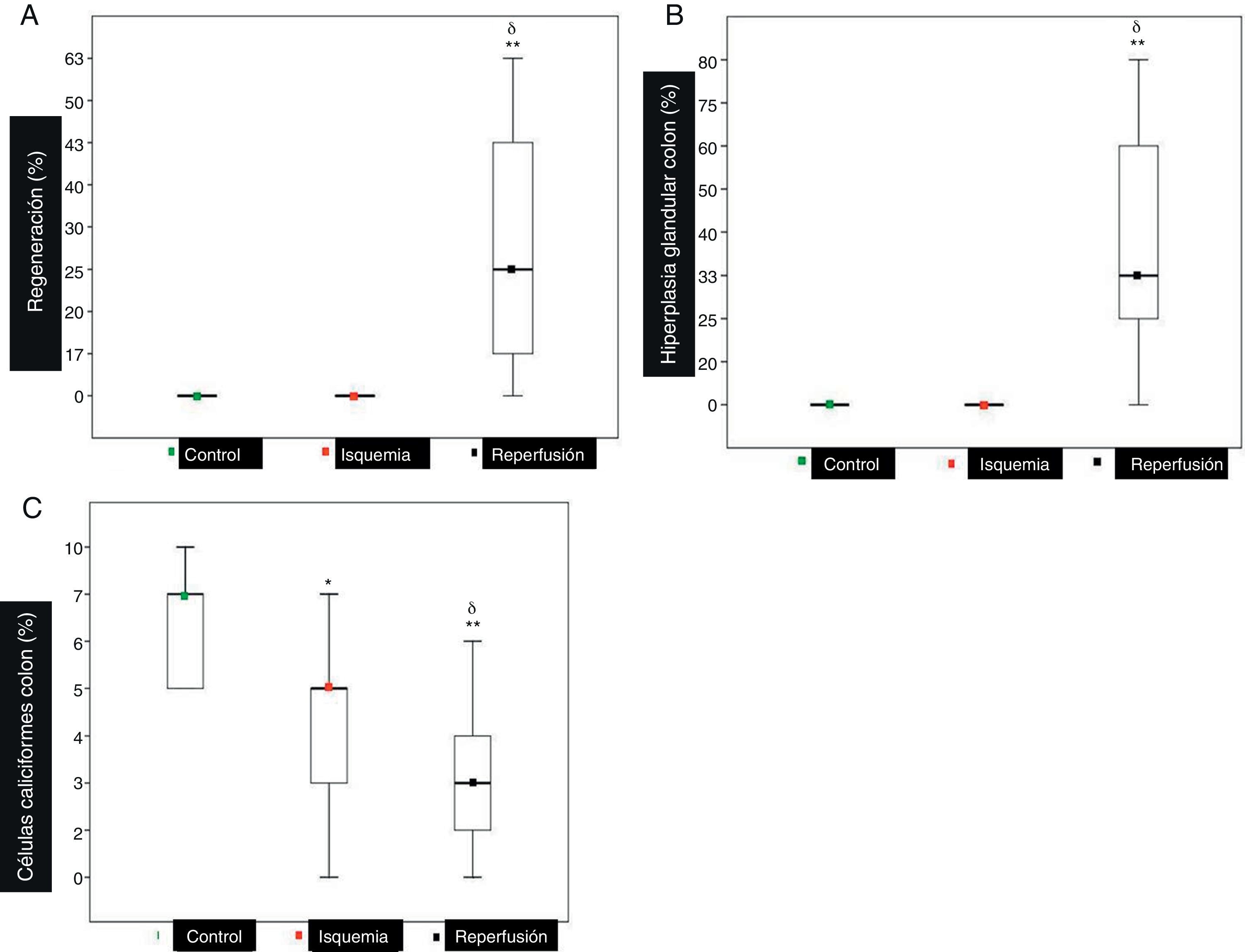
Referente a la arquitectura de vellosidades, no encontramos diferencias significativas al valorar el porcentaje de atrofia; sin embargo; la regeneración (fig. 3A) fue una características del grupo reperfusión comparado con los grupos isquemia y control (p<0,001).
Otros hallazgos histopatológicos. A) Se observa que la regeneración (25 [10-43]) es característica del grupo reperfusión. B) La hipertrofia glandular del colon (33 [25-60]) es característica del grupo reperfusión. C) El número de células caliciformes del colon en el grupo reperfusión se encuentra disminuido (3 [2-4]) comparado con (5 [3-7]) del grupo isquemia y (7 [5-10]) del grupo control.
Los datos se expresan como mediana (rango intercuartil).
*p<0,001 frente al grupo control.
**p<0,001 frente al grupo control.
***p<0,001 frente al grupo isquemia.
A pesar de encontrar casos aislados (4) de perforación en los grupos isquemia y reperfusión, este no fue un hallazgo significativo. La neumatosis, tanto en el intestino delgado como en el colon, no fue observada en ningún grupo. La hipertrofia glandular en el intestino delgado no determinó diferencias significativas entre los grupos. Mientras que en el colon estas diferencias (p<0,001) estuvieron presentes en el grupo reperfusión al comparar con los grupos isquemia y control (fig. 3B).
En el intestino delgado no se observaron diferencias significativas (p>0,01) respecto al recuento de células caliciformes y mitosis. En el colon se observó un descenso significativo (p<0,001) de la población de células caliciformes del grupo reperfusión comparado con los grupos isquemia y control (fig. 3C). Respecto a la mitosis, no se apreciaron diferencias significativas.
Ecografía Doppler color y anatomía patológicaAl correlacionar (rs) las variables ecográficas y de anatomía patológica, encontramos asociaciones directas significativas (p<0,01) entre la VSM, el IP y S/D respecto a: escala de Wallece/Keenan (rs=0,655; rs=0,593; rs=0,63) y Chiu delgado (rs=0,569; rs=0,522; rs=0,47), mientras que la correlación fue de tipo inverso (p<0,01) al asociar con la AMV (rs=–0,495; rs=–0,452; rs=–0,459) y células caliciformes del colon (rs=–0,525; rs=–0,45; rs=–0,518).
DiscusiónRespecto a la patogénesis de la lesión intestinal, existe una gran variedad de modelos experimentales que tratan de reproducir el fenómeno de isquemia-reperfusión, sin encontrar un modelo ideal21.
Flujo mesentéricoEstudios eco-Doppler efectuados por Kempley (prematuros de bajo peso) y Deeg (neonato a término) asociaron un incremento de la VSM en la AMS con ECN6,7. Sin embargo, Murdoch et al., al ajustar los resultados del estudio posnatal a la edad gestacional, no hallaron tal asociación10. Nuestra investigación experimental, al igual que Kempley y Deeg, registró un incremento de la VSM en el grupo de animales reperfusión respecto al control (tabla 2). Estos estudios indican que la VSM es un parámetro útil para identificar recién nacidos prematuros de bajo peso con un riesgo potencial a presentar una lesión intestinal, como parte del proceso de isquemia- reperfusión, que da origen a una de las causas de ECN3,4,7.
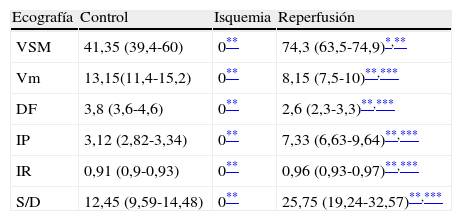
Registro y comparación del flujo de la arteria mesentérica superior tras 60 min de oclusión intestinal y 24 h de reperfusión, en los grupos control, isquemia y reperfusión
| Ecografía | Control | Isquemia | Reperfusión |
| VSM | 41,35 (39,4-60) | 0** | 74,3 (63,5-74,9)*,** |
| Vm | 13,15(11,4-15,2) | 0** | 8,15 (7,5-10)**,*** |
| DF | 3,8 (3,6-4,6) | 0** | 2,6 (2,3-3,3)**,*** |
| IP | 3,12 (2,82-3,34) | 0** | 7,33 (6,63-9,64)**,*** |
| IR | 0,91 (0,9-0,93) | 0** | 0,96 (0,93-0,97)**,*** |
| S/D | 12,45 (9,59-14,48) | 0** | 25,75 (19,24-32,57)**,*** |
Los datos son expresados como mediana (RI).
FD: flujo diastólico (cm/s); IP: índice de pulsatilidad; IR: índice de resistencia; RI: rango intercuartil I-II; S/D: índice sístole/diástole; Vm: velocidad media (cm/s); VSM: velocidad sistólica máxima (cm/s).
Existen pocos estudios posnatales sobre la AMS que busquen una asociación entre los índices de resistencia vascular (IP, IR y S/D)22 con lesión intestinal. En cuanto IP, los primeros estudios en la AMS neonatal no reportaron resultados alentadores6; sin embargo, al ajustarlo a la edad gestacional este índice marco un valor significativo importante en el pronóstico de ECN10.
En nuestro trabajo, encontramos resultados más claros acerca de estos índices de resistencia vascular observando un incremento importante del IP y S/D en el grupo de animales reperfusión, que constituyen una expresión indirecta de la regulación del flujo laminar en un vaso sanguíneo23.
Nosotros consideramos de utilidad el registro neonatal (prematuros de muy bajo peso) del IP y la VSM con factores pronóstico daño intestinal, en concordancia con varios autores24-28 que destacan su asociación con la lesión hipoxia-isquémica intestinal y con ECN.
Anatomía patológicaLos hallazgos más destacados de lesión intestinal, como hiperemia, ulceración, necrosis, denudación múltiple de vellosidades, disminución de la AMV, regeneración y reducción de la población de células caliciformes, permitieron activar: la cascada de estrés oxidativa, productos de lipoperoxidación y subtipos de oxígeno reactivos que, a su vez, promovieron un perfil de hiperexpresión de genes, los cuales se encuentran relacionados con mecanismos de defensa antioxidante según los estudios realizados en ratones endogámicos de 40g. por Bertoletto et al.29.
Ecografía y anatomía patológicaKim et al., en conejos de 10 a 12 semanas de vida (2 kg) en un modelo de ECN, observaron sobre la pared intestinal puntillados ecogénicos y granulaciones circunferenciales que tuvieron correlación con la congestión y la disminución de vellosidades, el edema submucoso y el infarto transmural de la serosa12. Choi et al., en conejos de 4 semanas de vida (486,6g) en un modelo de ECN (lipopolisacárido más hipoxia), observaron que los animales con ECN presentaron durante las dos primeras horas del modelo experimental un incremento de la VSM y del IR, insinuando que la isquemia intestinal puede ser un gatillo del proceso de ECN13. Centrándonos en nuestro modelo, Guillaumon y Couto., en ratas de 39,7 días (244g), encontraron una relación inversa entre el tiempo de isquemia y la recuperación intestinal en la fase de reperfusión30, por lo que nuestros hallazgos del flujo mesentérico (incremento de VSM) fueron inversamente proporcionales al daño intestinal agudo macroscópico (Wallace/Keenan) y microscópico (Chiu y AMV).
Estudios anteriores ya comentados nos recuerdan el importante papel que desempeñan las células caliciformes como mecanismo de barrera intestinal31,32. En este sentido, Varga et al., en ratas de 250g. aplicando un modelo de isquemia-reperfusión, observaron la alta resistencia que tienen las células caliciformes para presentar una lesión por isquemia y cómo la producción de péptidos trefoil influye en la restitución epitelial, favoreciendo el proceso de regeneración14,33. Sin embargo, hay que considerar que los prematuros, por su condición de inmadurez, responden de forma poco efectiva a la isquemia y la hipoxia4, con lo cual el papel que pueden cumplir las células caliciformes como mecanismo de barrera se encuentra disminuido. Nuestra investigación observó una relación inversa entre la VSM y la población de células caliciformes en la fase de reperfusión; estos hallazgos nos invitan a pensar que la regeneración intestinal fue poco efectiva y que el mecanismo de barrera proporcionado por las células caliciformes ha sufrido una lesión irreversible desencadenando una serie de procesos oxidativos e inmunitarios4,29,30,33.
Tenemos que referirnos a la importancia que tiene el neumoperitoneo como signo de perforación intestinal y lo que representa para el cirujano. Indicación absoluta de cirugía34,35. Silva, por su parte, sí logra demostrar en su trabajo que la ecografía tuvo alguna ventaja sobre la radiografía tradicional en el momento de observar gas libre abdominal9. Nuestro trabajo en ratas neonatales no fue tan optimista al correlacionar los parámetros Doppler de flujo mesentérico con perforación intestinal, quizás nuestros resultados se expliquen por las pocas horas de evolución del proceso de ECN (24 h).
El flujo mesentérico en neonatos prematuros es muy sensible durante los primeros días de vida, presentando una adaptación circulatoria transitoria como respuesta a los cambios hemodinámicos sistémicos y con el inicio de la alimentación enteral36. Estudios recientes en el periodo fetal37 lactante menor38 y de microcirculación 39 nos invitan a profundizar en nuevas investigaciones que colaboren con el diagnóstico y la evolución de la isquemia-reperfusión como causa de ECN.
En conclusión, en la fase de reperfusión, el incremento del flujo mesentérico expresado por la VSM y el IP podría pronosticar de forma significativa el potencial daño intestinal que ocurre a nivel macroscópico (hiperemia-úlcera-necrosis) y microscópico (disminución de vellosidades-destrucción de vellosidades-disminución de células caliciformes).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.



![Lesión intestinal. Puntuación macroscópica de Wallace/Keenan. A) Grupo control (0), ausencia de signos de dilatación o lesión intestinal. B) Grupo isquemia (5), dilatación intestinal y signos importantes de isquemia con zonas de necrosis. C) Grupo reperfusión (4 [3-5]), dilatación intestinal y signos de isquemia. Puntuación microscópica Chiu. D) Mucosa del íleon distal del grupo control (0) en la que se aprecian microvellosidades de características normales (flecha) con conservación de la AMV y EMV. E) Denudación masiva y necrosis más intensa de vellosidades en el íleon distal con zonas más marcadas de atrofia (flecha) en el grupo isquemia (4.46 [4,25-4,67]), además de un acortamiento intenso de la vellosidades. F) Denudación masiva, necrosis y zonas de hemorragia (flecha) de vellosidades en el íleon distal del grupo reperfusión (3 [2,86-3,5]), además de zonas de regeneración (línea punteada) con un acortamiento de la AMV y EMV. G) Mucosa del colon en el grupo control (0) de características normales. H) Mucosa del colon en el grupo isquemia (2,67 [2,33-3,33]), con zonas de hemorragia y necrosis focal. I) Mucosa del colon en el grupo reperfusión (3,1 [2,76-3,6]) con zonas de hemorragia más marcadas (flecha) y necrosis focal transmural. Los datos se expresan como mediana (rango intercuartil). p<0,001 frente al grupo control. p<0,001 frente al grupo isquemia. Lesión intestinal. Puntuación macroscópica de Wallace/Keenan. A) Grupo control (0), ausencia de signos de dilatación o lesión intestinal. B) Grupo isquemia (5), dilatación intestinal y signos importantes de isquemia con zonas de necrosis. C) Grupo reperfusión (4 [3-5]), dilatación intestinal y signos de isquemia. Puntuación microscópica Chiu. D) Mucosa del íleon distal del grupo control (0) en la que se aprecian microvellosidades de características normales (flecha) con conservación de la AMV y EMV. E) Denudación masiva y necrosis más intensa de vellosidades en el íleon distal con zonas más marcadas de atrofia (flecha) en el grupo isquemia (4.46 [4,25-4,67]), además de un acortamiento intenso de la vellosidades. F) Denudación masiva, necrosis y zonas de hemorragia (flecha) de vellosidades en el íleon distal del grupo reperfusión (3 [2,86-3,5]), además de zonas de regeneración (línea punteada) con un acortamiento de la AMV y EMV. G) Mucosa del colon en el grupo control (0) de características normales. H) Mucosa del colon en el grupo isquemia (2,67 [2,33-3,33]), con zonas de hemorragia y necrosis focal. I) Mucosa del colon en el grupo reperfusión (3,1 [2,76-3,6]) con zonas de hemorragia más marcadas (flecha) y necrosis focal transmural. Los datos se expresan como mediana (rango intercuartil). p<0,001 frente al grupo control. p<0,001 frente al grupo isquemia.](https://static.elsevier.es/multimedia/16954033/0000008000000003/v3_201403120105/S169540331300249X/v3_201403120105/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)
![Otros hallazgos histopatológicos. A) Se observa que la regeneración (25 [10-43]) es característica del grupo reperfusión. B) La hipertrofia glandular del colon (33 [25-60]) es característica del grupo reperfusión. C) El número de células caliciformes del colon en el grupo reperfusión se encuentra disminuido (3 [2-4]) comparado con (5 [3-7]) del grupo isquemia y (7 [5-10]) del grupo control. Los datos se expresan como mediana (rango intercuartil). *p<0,001 frente al grupo control. **p<0,001 frente al grupo control. ***p<0,001 frente al grupo isquemia. Otros hallazgos histopatológicos. A) Se observa que la regeneración (25 [10-43]) es característica del grupo reperfusión. B) La hipertrofia glandular del colon (33 [25-60]) es característica del grupo reperfusión. C) El número de células caliciformes del colon en el grupo reperfusión se encuentra disminuido (3 [2-4]) comparado con (5 [3-7]) del grupo isquemia y (7 [5-10]) del grupo control. Los datos se expresan como mediana (rango intercuartil). *p<0,001 frente al grupo control. **p<0,001 frente al grupo control. ***p<0,001 frente al grupo isquemia.](https://static.elsevier.es/multimedia/16954033/0000008000000003/v3_201403120105/S169540331300249X/v3_201403120105/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)


