En Portugal los datos del papel de Der p 1 y Der p 2 en niños con alergia al ácaro del polvo son escasos. La inmunoterapia específica (IE) con alérgenos es el único tratamiento que mejora los síntomas, reduce la necesidad de terapia farmacológica y modifica la historia natural de la enfermedad. Con este trabajo, los autores estudian la epidemiología local y buscan aclarar si el análisis molecular de los alérgenos principales es una ventaja para decidir y/o modificar la decisión de iniciar IE en niños con indicación clínica y sensibilizados a Dermatophagoides pteronyssinus.
MétodosEstudio retrospectivo de los niños con asma y/o rinitis. Período de estudio: enero de 2013 a diciembre de 2016. Criterios de inclusión: 1) prick-test positivo a Dermatophagoides pteronyssinus; y 2) enfermedad clínicamente relevante bajo tratamiento. Los valores de Der p 1 y Der p 2≥0,35kUA/l fueron considerados positivos. La significación estadística se estableció en p<0,05.
ResultadosSe incluyeron en el estudio 279 pacientes. Edad media 9,55 años (min. 4-máx. 17). El asma estuvo presente en 199 niños (71,3%) y rinitis en 245 (87,8%). Der p 1 y Der p 2 fue<0,35kUA/l en 29 (10,4%) pacientes. Der p 1/Der p 2 se correlacionó con el tamaño de la pápula de prick-test, con el valor de los eosinófilos y la IgE total.
ConclusionesDer p 1 y Der p 2 son alérgenos dominantes en nuestra población y puede haber beneficios en la determinación de estos niveles de alérgenos moleculares en pacientes con un prick-test positivo e indicación clínica para IE.
In Portugal, data on the role of Der p 1 and Der p 2 in patients with house dust mite (HDM) allergy are scarce. Allergen-specific immunotherapy (sIT) is the only treatment that improves symptoms, reduces the need for pharmacological therapy and modifies the natural history of the disease. With this study, the authors aim to understand the local epidemiology and to clarify if the molecular assay of major allergens is advantageous in deciding and/or modifying the decision to initiate sIT in children with clinical indication which are sensitized to Dermatophagoides pteronyssinus.
MethodsRetrospective study with analysis of patients with asthma and/or rhinitis. Study period: January/2013-December/2016. Inclusion criteria: 1) positive prick-test to Dermatophagoides pteronyssinus; and 2) clinically relevant disease under treatment. Assay Der p 1 and Der p 2 values ≥0.35 kUA/L were considered positive. Statistical significance was set at P<.05.
ResultsThe clinical files of 279 patients. Mean ages 9.55 years (min.4-max.17). Asthma was present in 199 children (71.3%) and rhinitis in 245 (87.8%). Der p 1 and Der p 2 was <0.35kUA/L in 29 (10,4%) patients. The value of Der p 1/Der p 2 correlated with the size of the prick-test papule, the value of the eosinophils and the total IgE.
ConclusionsDer p 1 and Der p 2 are dominant allergens in our population and there may be benefits in determining these molecular allergen levels in patients with a positive prick-test and a clinical indication for sIT prior to a decision of initiating sIT or not.
La prevalencia de las enfermedades alérgicas ha aumentado rápidamente en las últimas décadas en países desarrollados1,2. El Estudio internacional de asma y alergia en la infancia (ISAAC) investigó sistemáticamente la presencia de asma, rinoconjuntivitis y eczema en 1,2 millones de niños en 98 países3, y un estudio portugués en adultos encontró una prevalencia de asma del 16,8% y de rinitis del 33,6% en la región centro de Portugal4. Los alérgenos inhalantes desempeñan un papel fundamental en el desarrollo de estas enfermedades, y los ácaros del polvo o domésticos se consideran la fuente de alérgenos más importante en todo el mundo5,6. Los ácaros del polvo, y en particular el Dermatophagoides pteronyssinus, se consideran una fuente importante de sensibilización a alérgenos, constituyendo uno de los factores de riesgo más importantes para enfermedades respiratorias alérgicas en pacientes con predisposición genética7. Dichos alérgenos se clasifican en grupos en función de su composición bioquímica, homología y peso molecular. Hasta el momento la Organización Mundial de la Salud y el Subcomité de Nomenclatura de Alérgenos de la International Union of Immunological Societies (http://allergen.org/) han registrado 20 alérgenos asociados al Dermatophagoides pteronyssinus, muchos de los cuales son enzimas digestivas, ya que las heces de los ácaros son la fuente principal de exposición a alérgenos.
Algunos estudios han descrito una predominancia de anticuerpos IgE contra los grupos 1 (Der p 1) y 2 (Der p 2) de alérgenos de los ácaros del polvo en Europa8–11. Los datos sobre el papel de Der p 1 y Der p 2 en Portugal son todavía escasos.
Los alérgenos del grupo 1 (Der p 1, cisteín-proteasa de 25kDa) están presentes en altas concentraciones en las heces, mientras que los del grupo 2 (Der p 2, 14 kDa) se encuentran mayoritariamente en los componentes del cuerpo del ácaro7,12. Der p 1 y Der p 2 se consideran alérgenos mayores del Dermatophagoides pteronyssinus, ya que se identifican en el 80% de los pacientes sensibilizados a los ácaros11,13.
La inmunoterapia específica con alérgenos (ITA) es un arma importante en el tratamiento de la alergia respiratoria en casos selectos, siempre y cuando el paciente tenga hipersensibilidad mediada por IgE. Este proceso requiere una administración progresiva de cantidades crecientes de un alérgeno al que el paciente está sensibilizado, modulando la respuesta inmune nociva al alérgeno en cuestión y aliviando los síntomas alérgicos. Es el único tratamiento que mejora los síntomas, reduce la necesidad de tratamiento farmacológico y modifica el curso natural de la enfermedad alérgica14–16. Los efectos terapéuticos pueden ser de larga duración y el tratamiento previene la progresión de formas leves a graves de hipersensibilidad16–18.
Dado que las únicas vacunas actualmente disponibles en el mercado solo están estandarizadas para los alérgenos Der p 1 y Der p 2, el objetivo del estudio era evaluar la epidemiología local y esclarecer si la determinación por métodos moleculares de estos 2 alérgenos dominantes puede orientar o modificar la decisión de iniciar la ITA en niños sensibilizados a Dermatophagoides pteronyssinus con indicación clínica, tal y como se ha descrito en la literatura.
MétodosPacientesEstudio retrospectivo analítico mediante revisión de las historias clínicas de los pacientes derivados a la clínica ambulatoria de alergología del Centro Hospitalar de Trás-os-Montes e Alto Douro con asma y/o rinitis entre el 1 de enero y el 31 de diciembre de 2016.
Todos los pacientes fueron evaluados por un médico y se empleó un cuestionario detallado para establecer la naturaleza y gravedad de la clínica. La rinitis alérgica se diagnosticó en función de guías internacionales19, y el asma se definió en línea con los criterios de la Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma, como antecedentes de disnea recurrente, como episodios de sibilancias y/o tos y realización con resultado positivo de prueba de reversibilidad con broncodilatadores.
Prueba de punción cutánea (prick test)La sensibilización cutánea a Dermatophagoides pteronyssinus se evaluó por medio de prick test conforme a un proceso estandarizado20. Se emplearon extractos de alérgenos y soluciones de control de los Laboratorios Leti (Barcelona, España). El estudio de sensibilización a los principales alérgenos inhalantes incluyó ácaros (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Lepidoglyphus destructor), combinación de pólenes de gramíneas, combinación de pólenes de maleza, olivo, Parietaria judaica, Alternaria alternata y caspa de perro y de gato. Para las soluciones de control positiva y negativa se emplearon histamina (10mg/ml) y solución salina, respectivamente. La punción se realizó en la cara volar del antebrazo. El parámetro aplicado en la evaluación de la pápula resultante, medida a los 15minutos, fue el diámetro de mayor longitud. Se consideró que la prueba era positiva cuando el tamaño de la pápula era como mínimo de 3mm superior al tamaño del control negativo, siguiendo los criterios de la EAACI21. Los resultados también se expresaron en milímetros, refiriéndose al diámetro de mayor longitud de la pápula.
Análisis serológicoSe consideró eosinofilia un valor de eosinófilos ≥4% del total de leucocitos22.
La IgE total se determinó mediante inmunoanálisis de quimioluminiscencia (Roche) y se expresó en unidades internacionales por unidad de volumen (UI/l), considerándose elevada, dependiendo del sexo, si superaba las 230UI/l en los varones y las 170UI/l en las mujeres23.
Los ensayos con extracto de Dermatophagoides pteronyssinus, Der p 1 y Der p 2, se realizaron mediante ImmunoCAP (ImmunoCAP-100 y 250®, Thermo Fisher Scientific), siguiendo las instrucciones del fabricante. Los niveles de IgE específica se expresaron en kUA/l, considerándose positivos valores ≥0,35 kUA/l. Los resultados del ensayo se clasificaron en 6 categorías: bajo (≥0,35 a <0,70kUA/l), moderado (≥0,70 a <3,50kUA/l), alto (≥3,50 a <17,50kUA/l), muy alto-clase 1 (≥17,50 a<50,00kUA/l), muy alto-clase 2 (≥50,00 a <100,00kUA/l), y muy alto-clase 3 (≥100,00kUA/l).
Los criterios de inclusión fueron: 1) enfermedad con clínica significativa y síntomas perennes o presentes durante casi todo el año a pesar de tratamiento farmacológico; y 2) prick test positivo a Dermatophagoides pteronyssinus.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS versión 24.0 para Windows. Los niveles de IgE específica se expresan como medianas y rangos intercuartílicos (RIQ). La normalidad de los datos de edad, tamaño de la pápula en el prick test, valores de Der p 1 Der p 2, IgE total y eosinófilos se comprobó mediante la prueba de Kolmogorov-Smirnov. La prevalencia de reacciones mediadas por IgE específica se comparó mediante la prueba Chi cuadrado o el test exacto de Fisher. Se utilizó el test de Mann-Whitney para la comparación de datos cuantitativos entre grupos. La correlación entre distintas medidas serológicas se evaluó mediante el cálculo del cociente de correlación de Spearman (ρ). La capacidad discriminatoria del tamaño de la pápula en el prick test, el nivel de IgE total y el valor de eosinófilos para la predicción de resultados positivos para Der p 1/Der p 2 se evaluó mediante el análisis de las curvas de las características operativas del receptor (ROC), calculándose el área bajo la curva (ABC). Se estimó el ABC con su intervalo de confianza del 95% para cada biomarcador. El nivel de significación estadística se estableció en p<0,05.
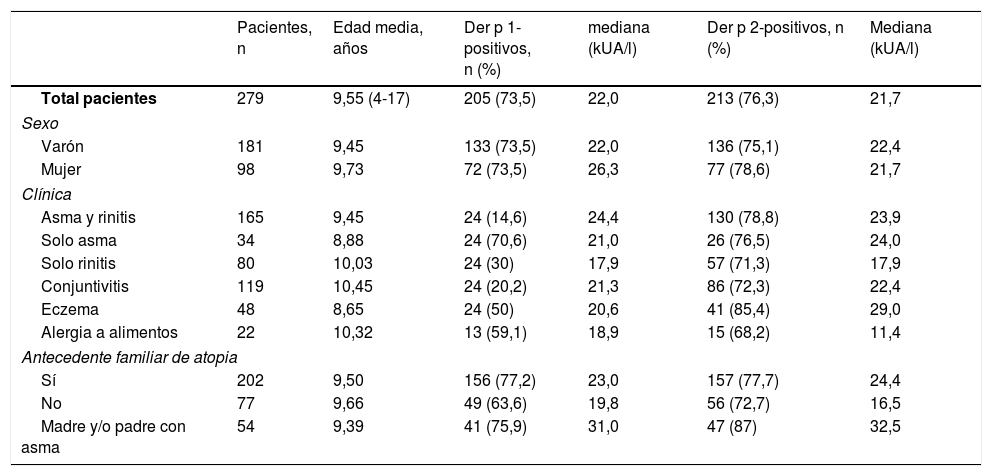
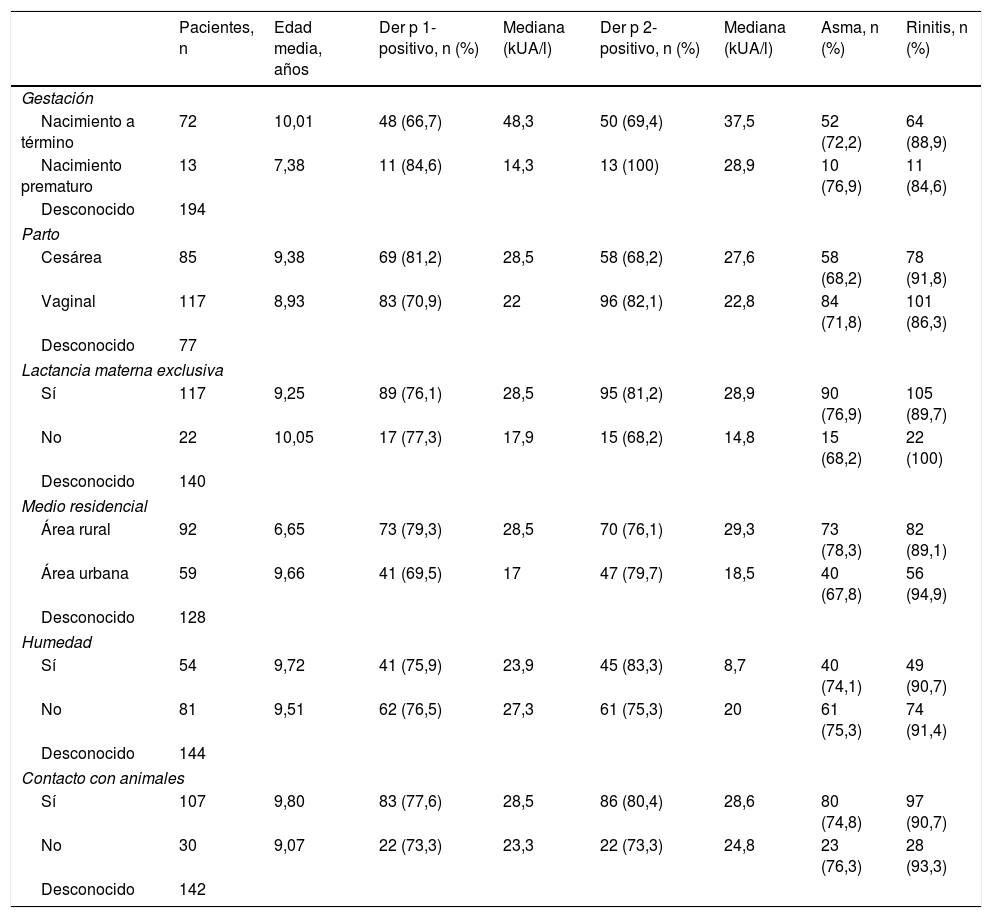
ResultadosEl análisis incluyó las historias médicas de 279 pacientes. Ciento ochenta y uno (64,9%) de sexo masculino y 98 (35,1%) de sexo femenino. La edad osciló entre los 4 y los 17 años, con una media de 9,55 (tabla 1). Ciento noventa y nueve (71,3%) tenían asma, 245 (87,8%) rinitis y 165 (59,1%) tanto asma como rinitis. Algunos pacientes tenían otras dolencias atópicas asociadas: conjuntivitis (42,7%), eczema atópico (17,2%) y alergias a alimentos (7,9%), de las que las más frecuentes fueron al pescado, el marisco, los huevos y la leche. Doscientos dos pacientes (72,4%) tenían antecedentes familiares de atopia y 54 (19,4%) antecedentes de asma materna o paterna. Se utilizó la prueba Chi cuadrado para analizar la asociación entre las historias clínicas de los pacientes y los antecedentes familiares de atopia, encontrándose que la asociación entre el asma (Chi cuadrado [1, n=279]=2,124, p=0,145) o la rinitis (Chi cuadraro [1, n=279]=3,572, p=0,059) y los antecedentes familiares de atopia no era significativa. También se empleó la Chi cuadrado para investigar la asociación entre las historias clínicas y los factores de riesgo tales como el nacimiento a término o prematuro, tipo de parto, lactancia materna exclusiva, características del lugar de residencia, humedad y contacto con animales. No se encontraron asociaciones estadísticamente significativas (tabla 2).
Características clínicas y demográficas de la muestra
| Pacientes, n | Edad media, años | Der p 1-positivos, n (%) | mediana (kUA/l) | Der p 2-positivos, n (%) | Mediana (kUA/l) | |
|---|---|---|---|---|---|---|
| Total pacientes | 279 | 9,55 (4-17) | 205 (73,5) | 22,0 | 213 (76,3) | 21,7 |
| Sexo | ||||||
| Varón | 181 | 9,45 | 133 (73,5) | 22,0 | 136 (75,1) | 22,4 |
| Mujer | 98 | 9,73 | 72 (73,5) | 26,3 | 77 (78,6) | 21,7 |
| Clínica | ||||||
| Asma y rinitis | 165 | 9,45 | 24 (14,6) | 24,4 | 130 (78,8) | 23,9 |
| Solo asma | 34 | 8,88 | 24 (70,6) | 21,0 | 26 (76,5) | 24,0 |
| Solo rinitis | 80 | 10,03 | 24 (30) | 17,9 | 57 (71,3) | 17,9 |
| Conjuntivitis | 119 | 10,45 | 24 (20,2) | 21,3 | 86 (72,3) | 22,4 |
| Eczema | 48 | 8,65 | 24 (50) | 20,6 | 41 (85,4) | 29,0 |
| Alergia a alimentos | 22 | 10,32 | 13 (59,1) | 18,9 | 15 (68,2) | 11,4 |
| Antecedente familiar de atopia | ||||||
| Sí | 202 | 9,50 | 156 (77,2) | 23,0 | 157 (77,7) | 24,4 |
| No | 77 | 9,66 | 49 (63,6) | 19,8 | 56 (72,7) | 16,5 |
| Madre y/o padre con asma | 54 | 9,39 | 41 (75,9) | 31,0 | 47 (87) | 32,5 |
Factores de riesgo para atopia
| Pacientes, n | Edad media, años | Der p 1-positivo, n (%) | Mediana (kUA/l) | Der p 2-positivo, n (%) | Mediana (kUA/l) | Asma, n (%) | Rinitis, n (%) | |
|---|---|---|---|---|---|---|---|---|
| Gestación | ||||||||
| Nacimiento a término | 72 | 10,01 | 48 (66,7) | 48,3 | 50 (69,4) | 37,5 | 52 (72,2) | 64 (88,9) |
| Nacimiento prematuro | 13 | 7,38 | 11 (84,6) | 14,3 | 13 (100) | 28,9 | 10 (76,9) | 11 (84,6) |
| Desconocido | 194 | |||||||
| Parto | ||||||||
| Cesárea | 85 | 9,38 | 69 (81,2) | 28,5 | 58 (68,2) | 27,6 | 58 (68,2) | 78 (91,8) |
| Vaginal | 117 | 8,93 | 83 (70,9) | 22 | 96 (82,1) | 22,8 | 84 (71,8) | 101 (86,3) |
| Desconocido | 77 | |||||||
| Lactancia materna exclusiva | ||||||||
| Sí | 117 | 9,25 | 89 (76,1) | 28,5 | 95 (81,2) | 28,9 | 90 (76,9) | 105 (89,7) |
| No | 22 | 10,05 | 17 (77,3) | 17,9 | 15 (68,2) | 14,8 | 15 (68,2) | 22 (100) |
| Desconocido | 140 | |||||||
| Medio residencial | ||||||||
| Área rural | 92 | 6,65 | 73 (79,3) | 28,5 | 70 (76,1) | 29,3 | 73 (78,3) | 82 (89,1) |
| Área urbana | 59 | 9,66 | 41 (69,5) | 17 | 47 (79,7) | 18,5 | 40 (67,8) | 56 (94,9) |
| Desconocido | 128 | |||||||
| Humedad | ||||||||
| Sí | 54 | 9,72 | 41 (75,9) | 23,9 | 45 (83,3) | 8,7 | 40 (74,1) | 49 (90,7) |
| No | 81 | 9,51 | 62 (76,5) | 27,3 | 61 (75,3) | 20 | 61 (75,3) | 74 (91,4) |
| Desconocido | 144 | |||||||
| Contacto con animales | ||||||||
| Sí | 107 | 9,80 | 83 (77,6) | 28,5 | 86 (80,4) | 28,6 | 80 (74,8) | 97 (90,7) |
| No | 30 | 9,07 | 22 (73,3) | 23,3 | 22 (73,3) | 24,8 | 23 (76,3) | 28 (93,3) |
| Desconocido | 142 | |||||||
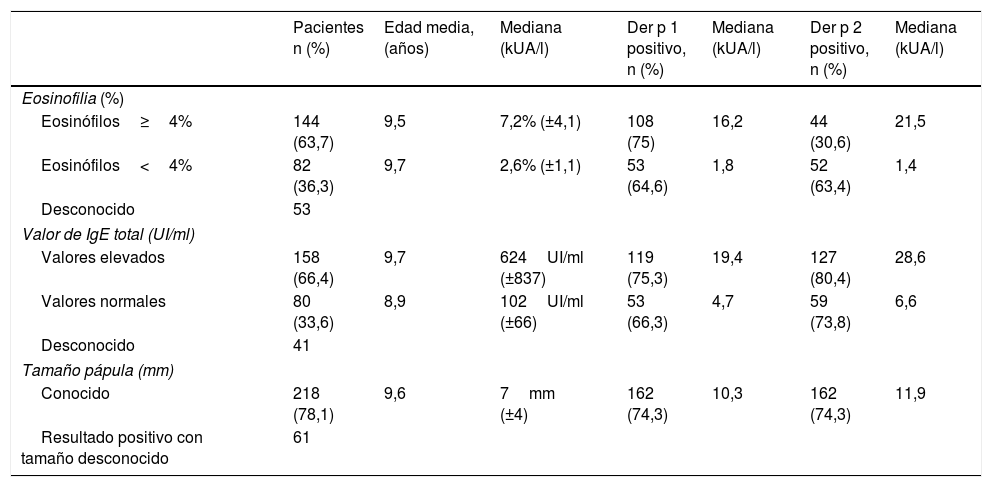
Se encontraron valores de eosinófilos ≥4% en 144 pacientes, y 158 tenían valores de IgE total elevados para su edad. La tabla 3 muestra los resultados positivos para Der p 1 y Der p 2.
Niveles séricos de Der p 1 y Der p 2 en relación con la cifra de eosinófilos, nivel de IgE total y tamaño de la pápula
| Pacientes n (%) | Edad media, (años) | Mediana (kUA/l) | Der p 1 positivo, n (%) | Mediana (kUA/l) | Der p 2 positivo, n (%) | Mediana (kUA/l) | |
|---|---|---|---|---|---|---|---|
| Eosinofilia (%) | |||||||
| Eosinófilos≥4% | 144 (63,7) | 9,5 | 7,2% (±4,1) | 108 (75) | 16,2 | 44 (30,6) | 21,5 |
| Eosinófilos<4% | 82 (36,3) | 9,7 | 2,6% (±1,1) | 53 (64,6) | 1,8 | 52 (63,4) | 1,4 |
| Desconocido | 53 | ||||||
| Valor de IgE total (UI/ml) | |||||||
| Valores elevados | 158 (66,4) | 9,7 | 624UI/ml (±837) | 119 (75,3) | 19,4 | 127 (80,4) | 28,6 |
| Valores normales | 80 (33,6) | 8,9 | 102UI/ml (±66) | 53 (66,3) | 4,7 | 59 (73,8) | 6,6 |
| Desconocido | 41 | ||||||
| Tamaño pápula (mm) | |||||||
| Conocido | 218 (78,1) | 9,6 | 7mm (±4) | 162 (74,3) | 10,3 | 162 (74,3) | 11,9 |
| Resultado positivo con tamaño desconocido | 61 | ||||||
Los niveles de Der p 1 y de Der p 2 fueron inferiores a 0,35kUA/l en 29 (10%) pacientes, y los valores positivos de Der p 1, Der p 2 o el mayor de ambos se muestran en la tabla 4. En pacientes con rinitis y sin asma se observó una proporción mayor de resultados positivos para Der p 2 (71,3%) en comparación con Der p 1 (30%), aunque la diferencia no era significativa. La proporción de resultados positivos para Der p 1 fue ligeramente mayor en pacientes con antecedentes familiares de atopia (77,2%) en comparación con pacientes que no los tenían (63,6%). No se encontraron diferencias en los resultados para Der p 2 (tabla 1).
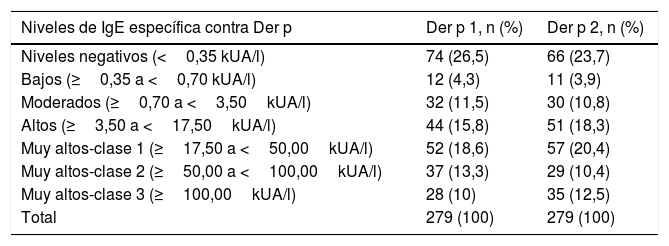
Prevalencia de la sensibilización a componentes de Der p para distintos niveles de IgE específica contra Der p (n=279)
| Niveles de IgE específica contra Der p | Der p 1, n (%) | Der p 2, n (%) |
|---|---|---|
| Niveles negativos (<0,35 kUA/l) | 74 (26,5) | 66 (23,7) |
| Bajos (≥0,35 a <0,70 kUA/l) | 12 (4,3) | 11 (3,9) |
| Moderados (≥0,70 a <3,50kUA/l) | 32 (11,5) | 30 (10,8) |
| Altos (≥3,50 a <17,50kUA/l) | 44 (15,8) | 51 (18,3) |
| Muy altos-clase 1 (≥17,50 a <50,00kUA/l) | 52 (18,6) | 57 (20,4) |
| Muy altos-clase 2 (≥50,00 a <100,00kUA/l) | 37 (13,3) | 29 (10,4) |
| Muy altos-clase 3 (≥100,00kUA/l) | 28 (10) | 35 (12,5) |
| Total | 279 (100) | 279 (100) |
La distribución de las variables edad, tamaño de la pápula en el prick test, niveles de Der p 1, Der p 2, IgE total y eosinófilos no era normal (p<0,001).
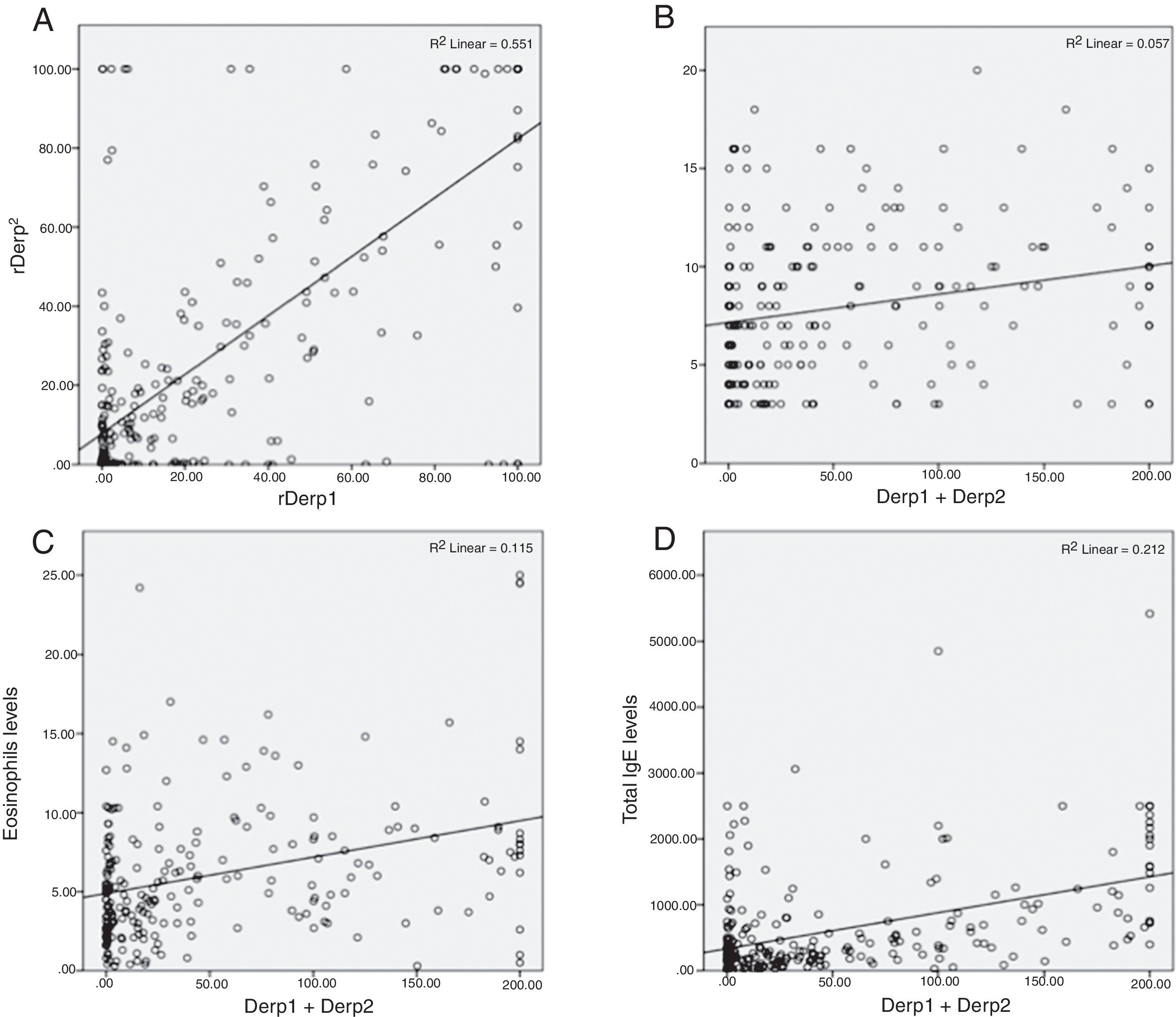
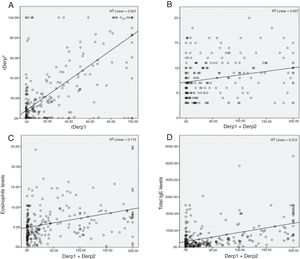
Se investigó la presencia de correlaciones entre determinaciones serológicas calculando el coeficiente de Spearman, detectándose una correlación positiva y fuerte entre las variables Der p 1 y Der p 2 (ρ=0,621, p<0,001). Se encontró una correlación positiva débil entre las variables Der p 1/Der p 2 y el tamaño de la pápula en el prick test (ρ=0,324, p<0,001; ρ=0,252, p<0,001) y entre las variables Der p 1/Der p 2 y los eosinófilos (ρ=0,288, p<0,001; ρ=0,371, p<0,001). Se encontró una correlación moderada entre las variables Der p 1/Der p 2 y el nivel de IgE total (ρ=0,346, p<0,001; ρ=0,449, p<0,001) (fig. 1).
Correlaciones entre los niveles de IgE específica frente a extracto de ácaro del polvo y los componentes aislados Der p 1 y Der p 2 y otros niveles séricos. A. Nivel de IgE frente a Der p 1 en relación con el nivel de IgE frente a Der p 2. B. Suma de IgE frente a Der p 1 y Der p 2 en relación con el tamaño de la pápula en el prick test. C. Suma de IgE frente a Der p 1 y Der p 2 en relación con la cifra de eosinófilos. D. Suma de IgE frente a Der p 1 y Der p 2 en relación con la IgE total.
No se hallaron correlaciones significativas entre el tamaño de la pápula en el prick test y el valor de los eosinófilos (ρ=–0,144, p=0,051) o el nivel de IgE total (ρ=–0,055, p=0,478), ni entre Der p 1/Der p 2 y la edad (ρ=–0,052, p=0,388/0,379).
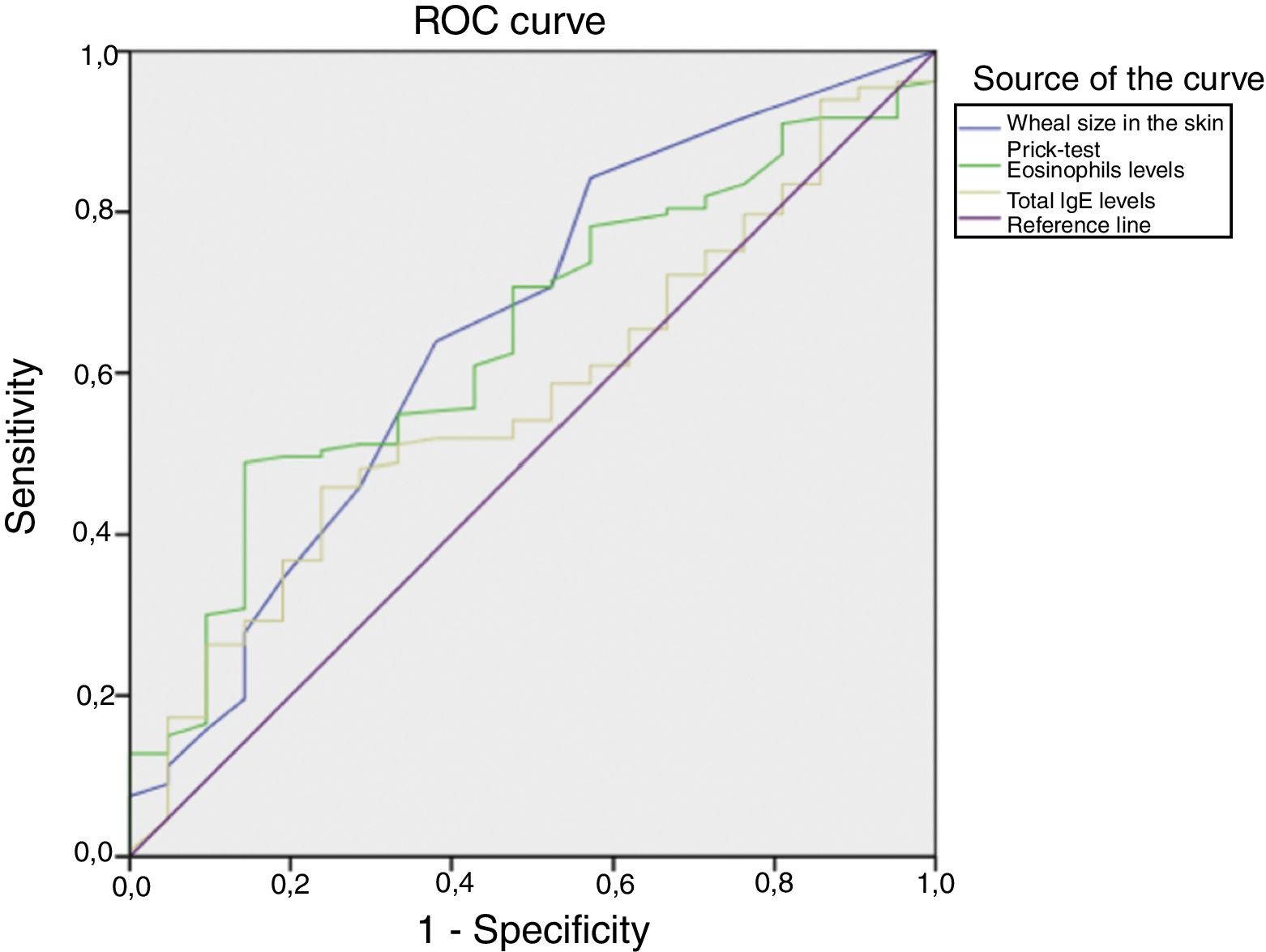
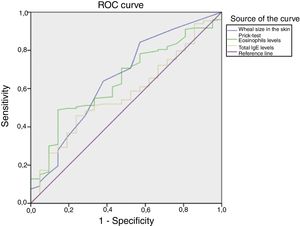
La figura 2 muestra las curvas ROC que representan la capacidad del tamaño de la pápula en el prick test, los eosinófilos y el nivel de IgE total para predecir resultados positivos para Der p 1/Der p 2. El riesgo se estimó mediante el área bajo la curva ROC, calculada para cada parámetro individual y para la combinación de las 3 variables. El análisis de la combinación del prick test, los eosinófilos y el nivel de IgE total reveló un valor predictivo significativo, con un ABC de 0,653. Individualmente, el tamaño de la pápula y los eosinófilos tenían valores predictivos mayores que el de la IgE total, con ABC de 0,673 y 0,641 en comparación con un ABC de 0,598. No obstante, todos los parámetros individuales se considerarían mediocres para discriminar entre valores positivos y negativos de Der p 1 y Der p 2. Se utilizó el índice de Youden para establecer un punto de corte óptimo para el tamaño de la pápula correspondiente a un resultado positivo (4,5mm), con una sensibilidad del 80,5% y una especificidad del 50%, y también para el valor relativo de eosinófilos, que fue del 5,55%, con una sensibilidad del 49,8% y una especificidad del 82,6%. La eficacia predictiva del nivel de IgE total no fue significativa.
DiscusiónLos ácaros del polvo son una de las principales fuentes de alérgenos perennes y una causa importante de la rinitis y el asma alérgicas. La sensibilización a alérgenos de los ácaros en los primeros años de vida tiene un impacto clínico significativo en la función pulmonar de la población pediátrica debido a las sibilancias, y se asocia a una evolución respiratoria menos favorable a largo plazo24. Asimismo, un porcentaje alto de los pacientes con antecedentes familiares de atopia, como se pudo observar en nuestra muestra (72,4%, en particular los pacientes con padres asmáticos), presentan un riesgo mayor de sufrir asma persistente en la edad adulta25,26.
La prevalencia de la sensibilización a los ácaros descrita en la literatura oscila entre los 65 y los 130 millones de personas en la población general mundial, y puede ascender hasta el 50% en pacientes asmáticos27. Las 2 especies de ácaros más importantes en la investigación en alergia son Dermatophagoides pteronyssinus y Dermatophagoides farinae. El género Dermatophagoides es probablemente el más estudiado dentro de los ácaros del polvo, aunque las especies dominantes varían según la región geográfica, lo que sugiere una adaptación especializada27. En Portugal se registra una alta prevalencia de los ácaros del polvo en todas las regiones, y la importancia del Dermatophagoides pteronyssinus es bien conocida. Según el mapa acarológico realizado en Portugal el Dermatophagoides pteronyssinus es el ácaro más prevalente en la zona septentrional del interior de Portugal. Esta es la zona donde se llevó a cabo nuestro estudio, con una prevalencia del 79,5%. Dermatophagoides pteronyssinus y Dermatophagoides farinae tienen una reactividad cruzada alta, y en algunas áreas geográficas el Dermatophagoides farinae es más prevalente. Este no es el caso en nuestra región, pues según indica el mapa acarológico la prevalencia de Dermatophagoides farinae es baja, de aproximadamente el 6,8%28. En nuestro estudio el 73,5% de los pacientes con pruebas positivas para Der p estaban sensibilizados a Der p 1 y el 76,3% a Der p 2. La tasa de sensibilización a Der p fue comparable a las tasas descritas en cohortes europeas (80%)24.
Aunque se han identificado y secuenciado al menos 20 componentes alergénicos de los ácaros del polvo, varios estudios demuestran que Der p 1 y Der p 2 son los alérgenos de los ácaros con mayor relevancia clínica24,29,30, lo que también se observó en los pacientes sensibilizados a Der p en nuestro estudio. El 10% de los pacientes sometidos a pruebas (29/279) tuvieron resultados negativos tanto para Der p 1 como para Der p 2. Por lo tanto, este estudio corrobora que Der p 1 y Der p 2 son los componentes alérgenicos mayores de los ácaros en nuestro grupo de pacientes portugueses.
La fuerte correlación entre los niveles séricos de eosinófilos y de IgE total contra Der p 1 y Der p 2 corrobora el papel preponderante de ambos alérgenos en la respuesta frente a los ácaros mediada por IgE en Portugal. El tamaño de la pápula y el valor de los eosinófilos tienen un valor predictivo significativo para discriminar entre niveles positivos y negativos de Der p 1 y Der p 2, y el punto de corte óptimo de 4,5mm para el tamaño de la pápula tiene una sensibilidad del 80,5% y una especificidad del 50%, mientras que el de 5,55% para los eosinófilos tiene una sensibilidad del 49,8% y una especificidad del 82,6% (fig. 2).
La inmunoterapia de alérgenos ha mostrado cierto potencial para modificar el curso de la enfermedad mediante la inducción de cambios beneficiosos en la respuesta inmune, e impidiendo parcial o totalmente el inicio de asma o el desarrollo de nuevas sensibilizaciones a alérgenos. Parece capaz de mejorar las manifestaciones clínicas (nasales, oculares y respiratorias), reducir la necesidad de fármacos de rescate, mejorar los índices de función pulmonar y, lo que es más importante, tiene el potencial de causar un cambio intrínseco en el curso de la enfermedad, previniendo en parte o totalmente el desarrollo de asma alérgica o nuevas sensibilizaciones31. En nuestra muestra alrededor del 71,3% de los pacientes tenía asma, la amplia mayoría tenía rinitis (87,8%) y solo el 28,7% tenía rinitis sin asma. El inicio temprano del tratamiento puede ofrecer ventajas relevantes, pero como las vacunas contra Dermatophagoides pteronyssinus actualmente disponibles en el mercado solo están estandarizadas para Der p 1 y Der p 2, en nuestra muestra solo el 89,6% de los pacientes sería subsidiario de inmunoterapia con alérgenos a ácaros del polvo. El conocimiento del perfil molecular de IgE del paciente contribuye a la caracterización de su perfil de riesgo, ya que describe los principales alérgenos a los que el paciente está sensibilizado. También ayuda a seleccionar los pacientes para la ITA y a optimizar la selección de los componentes de la inmunoterapia.
Recientemente se ha descrito que Der p 23, que se encuentra en la membrana quitinosa de las heces de los ácaros, puede unirse a IgE con títulos similares a los de Der p 1 y 2, y ha mostrado una actividad considerable en pruebas de degranulación de basófilos. Los títulos mostraron una afinidad alta en la unión con Der p 1 y Der p 2. No obstante, algunos individuos exhiben una alta frecuencia de fijación de IgE a Der p 23 sin fijación a Der p 1 o Der p 211,32. En función de estos hallazgos sería importante estudiar el 10% de los pacientes de la muestra con resultados negativos para Der p 1 y Der p 2, y comprobar si tienen resultados positivos para Der p 23. En el momento en que se realizó el estudio el ensayo para Der p 23 no se había comercializado, siendo, por tanto, un aspecto a investigar en el futuro.
En resumen, el presente estudio confirmó que Der p 1 y Der p 2 son alérgenos mayores de los ácaros del polvo en la población pediátrica atendida en un hospital del Norte de Portugal, ya que de todos los pacientes con pruebas positivas para Dermatophagoides pteronyssinus, el 73,5% estaban sensibilizados a Der p 1 y el 76,3% a Der p 2. El estudio también mostró que los resultados del inmunoanálisis de Der p 1 y Der p 2 eran negativos en el 10,4% (29/279) de los pacientes. Algo similar ya se ha observado en otros neumoalérgenos importantes33,34. Esto, junto con nuestros resultados, demuestra que el estudio de las fuentes de alérgenos mediante prick test o inmunoanálisis de IgE específica constituyen una evaluación incompleta para la prescripción adecuada de ITA. Como las vacunas frente Dermatophagoides pteronyssinus actualmente disponibles en el mercado solo están estandarizadas para Der p 1 y Der p 2, concluimos que la determinación de los niveles de Der p 1/Der p 2 podría ser beneficiosa en pacientes con prick test positivo e indicación clínica para ITA antes de tomar la decisión de iniciar la inmunoterapia, ya que el 10% de los pacientes pediátricos con manifestaciones clínicas de alergia a ácaros del polvo no se beneficiarían de este tratamiento, a pesar de los recursos humanos y económicos empleados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Los datos de este estudio se presentaron en forma de póster en el Congreso Anual de la European Academy of Allergy and Clinical Immunology (EAACI) celebrado en Helsinki en 2017.