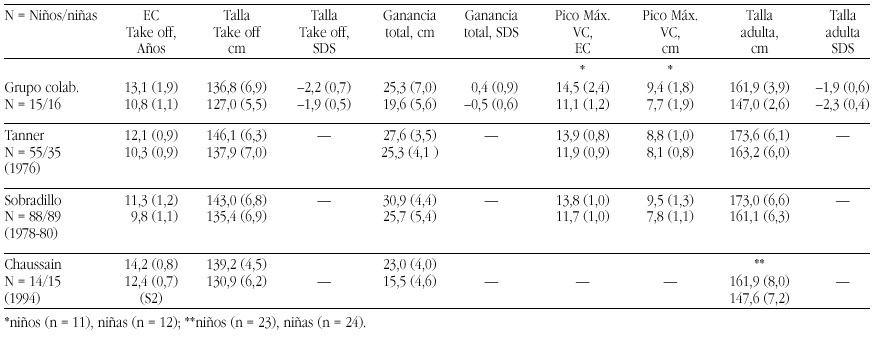
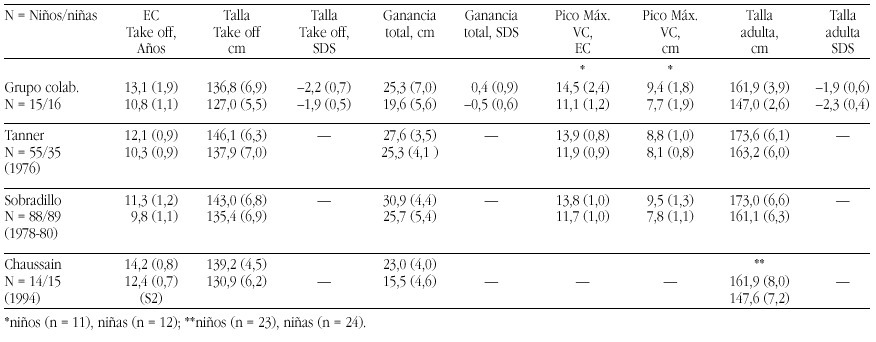
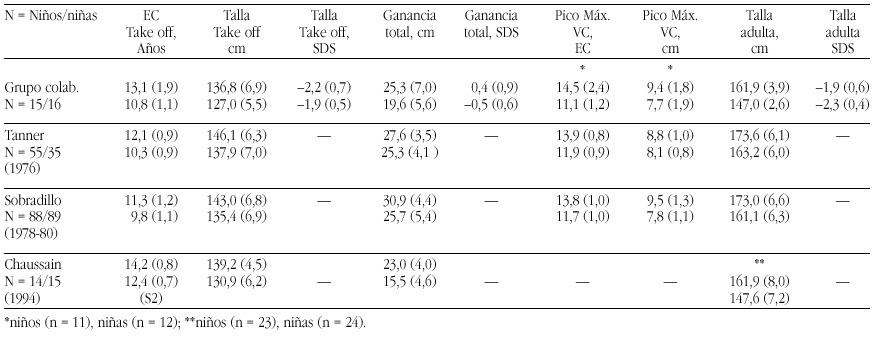
Las prácticas de nutrición infantil constituyen el experimento incontrolado de mayor duración y sin consentimiento informado de la historia de la medicina.
Frank Oski.
Hasta hace muy poco tiempo la mayoría de los cambios producidos en el campo de la nutrición infantil se basaban en el empirismo. Si un niño sobrevivía y se desarrollaba, se consideraba que la nutrición había tenido éxito. Esto se convirtió en una regla estándar, hasta que se probaba una nueva idea, y si sobrevivían unos cuantos lactantes, la nueva moda se convertía en norma. Es lógico pensar que la nutrición infantil no podía evolucionar de otra forma, ya que puede decirse que los métodos químicos aplicables a la nutrición son todavía recientes1.
Con la llegada de la revolución industrial, las mujeres se dieron cuenta de que podían ganar más dinero trabajando en las fábricas que como nodrizas. Las madres, biológicas o adoptivas, intentaron encontrar un substitutivo de la lactancia materna y experimentaron con leches de casi todos los mamíferos, generalmente con resultados desastrosos. A finales del siglo XIX, cuando se determinó la composición química de los diversos tipos de leche, se efectuaron modificaciones de la leche de los animales tratando de aproximar su composición a la de la leche humana1. La manipulación de la composición de las fórmulas fue el anuncio del establecimiento de la pediatría como especialidad. Progresivamente se fueron introduciendo diferentes modificaciones técnicas, hasta llegar a la década de los treinta en la que se añadieron vitaminas a las fórmulas y, posteriormente, hierro, consiguiéndose un descenso de tales deficiencias en la población infantil. Actualmente, aparte de haberse reconocido las lesiones permanentes que puede producir el déficit de hierro, se está acumulando cada vez más información sobre el papel nutricional que desempeñan otros oligoelementos, también conocidos como elementos traza, gracias fundamentalmente a la utilización de técnicas analíticas de alta resolución. En este momento está bien establecido que los oligoelementos pueden ser sustancias limitantes del crecimiento y del desarrollo, no sólo a causa de deficiencias ambientales sino por la ingesta de dietas desequilibradas que en el pasado fueron aceptadas como adecuadas2.
Se consideran oligoelementos o elementos traza a aquellos que desempeñan un papel fisiológico fundamental o presentan toxicidad potencial y que se encuentran normalmente en cantidades inferiores a 250 mg/g en los tejidos corporales, alimentos o agua de bebida.
No todos los elementos traza tienen la misma importancia en términos de salud pública (tabla 1). Para ciertos elementos como hierro, yodo, zinc, flúor, cobre, selenio, molibdeno y cromo se conocen los efectos tanto de la deficiencia como de la sobreexposición. Para otros, como el manganeso, se sabe que desempeña varias funciones biológicas como cofactor enzimático; sin embargo, tanto las ingestas bajas como elevadas no causan problemas sustanciales en la población infantil2. Además, en los últimos años se discuten las evidencias de otros elementos minerales potencialmente esenciales. El objetivo de nuestra revisión será el de revisar únicamente el papel específico de la deficiencia de aquellos elementos traza con papel reconocido sobre el crecimiento y desarrollo de los niños.
Debe resaltarse que las deficiencias relacionadas con un único elemento traza puede revelar resultados inconsistentes, lo que puede deberse a que tal situación rara vez se da en los niños. Lo más habitual es que se produzcan deficiencias globales y que, por lo tanto, se vean involucrados diferentes nutrientes. Cuando se plantea la corrección de estos trastornos, resulta difícil poner en marcha estudios controlados que permitan ver los efectos de una suplementación específica.
Papel del eje somatotrofo
Las somatomedinas (IGF) son una familia de péptidos que median muchas de las acciones mitógenas y anabólicas de la GH. Esta última regula e induce la síntesis de IGF-I, cuyos niveles circulantes corresponden, fundamentalmente, al sintetizado en el hígado. Durante años se mantuvo la controversia sobre si la acción promotora del crecimiento de la GH estaba mediada fundamentalmente por la IGF-I circulante o por la inducida localmente en el cartílago. Estudios recientes en rata confirman que la acción promotora del crecimiento no está mediada por la IGF hepática circulante, sino por la IGF-I producida localmente en los condrocitos del cartílago, actuando, por tanto, a través de un mecanismo autocrino/paracrino (fig. 1).
En general, las somatomedinas son potentes estimuladores de la proliferación y diferenciación celular e inhiben la apoptosis. A nivel de la placa de crecimiento, el IGF-I estimula la multiplicación de los condrocitos y promueve el crecimiento en longitud. Por añadidura, el IGF-I impulsa la expansión clonal en la capa celular proliferativa y estimula la captación de sulfato por los glucosaminoglicanos3. Por el contrario, las hormonas tiroideas bloquean la expansión clonal, pero estimulan la maduración del condrocito. Con respecto al tejido magro, un recambio continuo de proteínas mantiene la integridad y calidad de músculo esquelético. GH, IGF-I y los esteroides sexuales estimularían el crecimiento muscular incrementando la síntesis de proteínas y también jugaría papel la insulina disminuyendo su destrucción.
Aparte de los macronutrientes, hay hechos que demuestran que los micronutrientes juegan un papel en la regulación del eje somatotrofo.
Ingesta de micronutrientes recomendada
En muchas situaciones, los investigadores inicialmente pueden darse cuenta de una anormalidad potencial en la situación de un elemento traza mediante la comparación de la ingesta diaria con los valores de requerimiento diarios recomendados (p. ej., tal proceder llevó al reconocimiento del papel desempeñado por la deficiencia de zinc en la patogenia de la acrodermatitis enteropática). En la tabla 2 proporcionamos los valores de referencia ofrecidos por el Departamento de Salud del Reino Unido en relación con los micronutrientes esenciales4. El requerimiento dietético recomendado -valor de referencia (VR)- es facilitado sólo en algunos casos, entendiendo por tal aquel que cubre al 97,5% de la población sana del grupo específico de población5. Para otros elementos traza, al no disponer de información fiable, se recurre a enmarcarlos dentro de una categoría más amplia que se denomina de "ingesta segura"5.
Los datos que proporcionamos deben tratarse con precaución ya que se han diseñado para aplicarse a una población determinada, aquella en la que se obtuvieron tales valores. Es necesario reconocer que nos encontramos con dificultades para establecer con aceptable precisión las recomendaciones para los elementos traza. Parece claro, por lo tanto, que si un determinado sujeto presenta valores que se encuentran por debajo de los recomendados, esto sólo representaría que tendría unas posibilidades mayores de tener una deficiencia y que sería necesario emprender investigaciones en orden a llegar a conclusiones definitivas5.
Zinc
El organismo humano ha desarrollado los adecuados mecanismos homeostáticos que le permiten controlar las concentraciones de zinc. Dado que la gran mayoría de las funciones fisiológicas asociadas con este oligoelemento tienen lugar a nivel intracelular, el 95% de él se encuentra precisamente dentro de este compartimento. El National Research Council, Food and Nutrition Board establece las recomendaciones de ingesta de zinc en 3-5 mg/día para lactantes, 5-10 mg/día para preescolares, 10 mg/día para escolares, 12 mg/día para adolescentes mujeres y 15 mg/día para adolescentes hombres6. Se absorbe el 20-30% del zinc administrado por vía oral.
El zinc se encuentra ampliamente distribuido por todo el organismo. Hay alto contenido en el músculo, huesos, piel y cabellos, hígado, sistema nervioso central, etc. Las concentraciones más altas se encuentran en la retina y en genitales masculinos, especialmente en la próstata. El hígado, a través de la metalotioneína, tiene un papel importante en el metabolismo del zinc, y es reserva específica en caso de una demanda inminente.
La deficiencia de zinc puede producir retraso de crecimiento y pubertad retrasada en humanos. Además, puede afectar a la función inmune lo que puede conducir a un aumento en la incidencia de infecciones, especialmente digestivas y dermatológicas. Si la deficiencia de zinc se produce en las primeras etapas de la vida, también puede condicionar un retraso en el desarrollo psicomotor. Son varios los mecanismos a través de los cuales el zinc puede influenciar la regulación del crecimiento (tabla 3).
El zinc participaría en la regulación de la ingesta alimenticia probablemente a través de su influencia sobre la función del hipotálamo. El zinc puede afectar las concentraciones de varios neurotransmisores y/o aminoácidos y puede influenciar el metabolismo de los carbohidratos.
Tal como se esperaría, el zinc influencia la actividad de varias metaloenzimas. La actividad de algunas metaloenzimas que contienen zinc se encuentra disminuida en ratas con deficiencia de este elemento traza, si bien tal alteración parece guardar una relación variable en relación con las manifestaciones clínicas. El hecho de esta inconsistente relación podría estar relacionada con variaciones en las afinidades de unión del zinc a las diferentes metaloenzimas, a variaciones en la magnitud del recambio del elemento traza o a los diferentes tejidos implicados7.
El zinc participa también en las cascadas de transducción de señales como cofactor de la proteína quinasa C. Además, recientemente se ha demostrado que el zinc desempeña un papel esencial en la transcripción génica; numerosos factores de transcripción poseen una estructura denominada "dedo de zinc". Esta estructura asume una conformación de un dominio proteico similar a la de un dedo en el que aproximadamente 30 aminoácidos estabilizan su estructura tridimensional a través de un átomo de zinc que se requiere para la interacción del factor de transcripción con el DNA. Los factores de transcripción que modulan la síntesis de RNA tienen varios dominios en formas de dedos de zinc y numerosas hormonas, entre ellas las sexuales y tiroideas, así como las vitaminas A y D, ejercen su función por unión con factores de transcripción que contienen dichas estructuras8,9.
A lo anterior se añade el hecho de que el zinc puede influenciar la secreción de GH, IGF-I, hormonas tiroideas y esteroides sexuales10. Diferentes estudios en animales demuestran que una deficiencia de zinc reduce las concentraciones circulantes de IGF-I y los receptores de GH a nivel hepático. También existen evidencias clínicas de que la suplementación con zinc podría revertir el retraso de crecimiento ejerciendo su efecto a través del eje de la hormona de crecimiento11,12,13,14. Otro posible mecanismo por el cual la deficiencia de zinc podría condicionar un retraso de crecimiento sería alterando el metabolismo de las hormonas tiroideas15.
Además de los efectos sobre el crecimiento, el zinc puede condicionar la función gonadal, especialmente en los hombres. Prasad et al16 describieron por primera vez una entidad clínica por deficiencia de zinc que se caracterizaba por baja estatura, hipogonadismo, anemia leve y bajos niveles plasmáticos de zinc. Esta deficiencia se debería a una dieta rica en cereales no refinados y pan sin levadura. Estos contienen un nivel elevado de fibra y fitato, que producen quelación con el zinc en el intestino y evitan la absorción. Si para unos el hipogonadismo se debería a una inhibición de la secreción hipofisaria de gonadotrofinas, otros sugieren que el eje hipotálamo-hipofisario estaría normal y que el trastorno se debería a una afectación de las células de Leydig. Lo que si parece claro es que el déficit de zinc puede interferir el brote de crecimiento que se observa normalmente en la pubertad del hombre a través de una disminución de la producción testicular de andrógenos17.
Crecimiento fetal y zinc
Estudios realizados en animales durante la gestación han demostrado una asociación entre la deficiencia de zinc durante las primeras semanas y la presencia de aborto y malformaciones congénitas10. Si la deficiencia se mantiene durante todo el embarazo, tal situación puede llevar a afectar el crecimiento del feto, prematuridad y/o complicaciones del parto. Por el contrario, la administración de suplementos del elemento traza a los animales en situaciones de carencia durante la gestación conduce a un aumento del peso al nacimiento y a disminuir la incidencia de prematuridad10. En los humanos existen también estudios que sugieren una asociación entre la concentración de zinc a nivel de tejido materno y retraso de crecimiento fetal. Cherry et al18 estudiaron un grupo de adolescentes en situación de riesgo para una deficiencia de zinc leve y encontraron que si se administra como suplemento 25 semanas antes de la gestación reducía la incidencia de bajo peso y prematuridad.
El mecanismo mediante el cual la deficiencia de zinc puede inducir prematuridad no está claro, aunque podría deberse a una interferencia con la función placentaria. Otros mecanismos podrían también estar implicados. Debe resaltarse que el efecto de suplementar con zinc parece resultar beneficioso en el caso de las embarazadas deficientes, pero no parece desempeñar ningún papel positivo en situaciones de aporte adecuado.
Crecimiento postnatal y zinc
Está plenamente documentado que la deficiencia de zinc puede afectar el crecimiento postnatal. Muchos de los estudios demuestran que la deficiencia de zinc se asocia con diferentes factores de riesgo, tales como el destete precoz, alimentación con leche de vaca entera, diarrea y malnutrición. Dado que en la actualidad no se dispone de métodos certeros que permitan valorar el estado nutricional de zinc19, resulta difícil conocer cual es la prevalencia de esta deficiencia y, más aún, detectar las posibles deficiencias moderadas o marginales20.
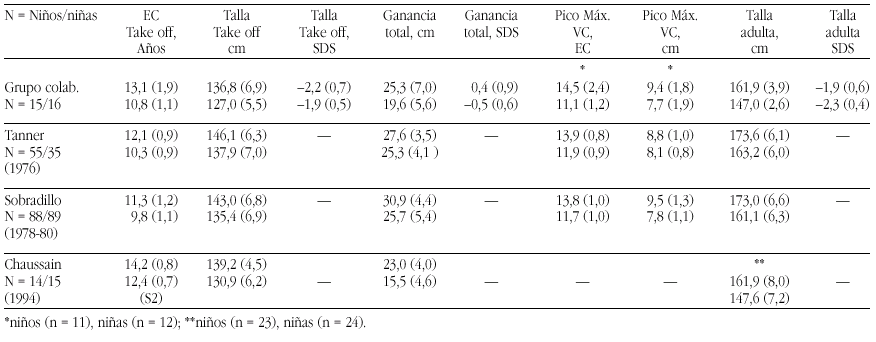
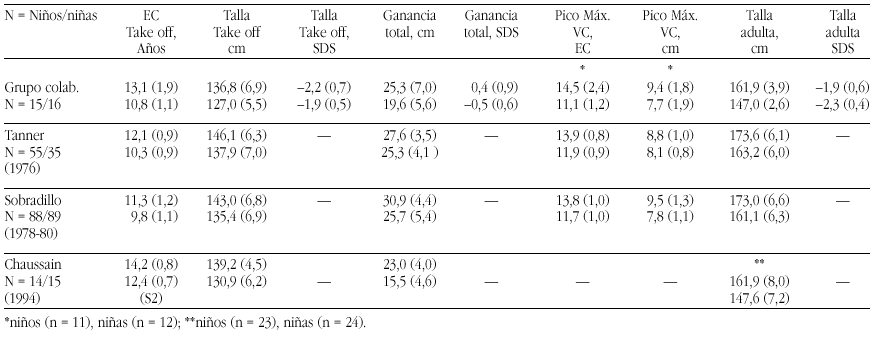
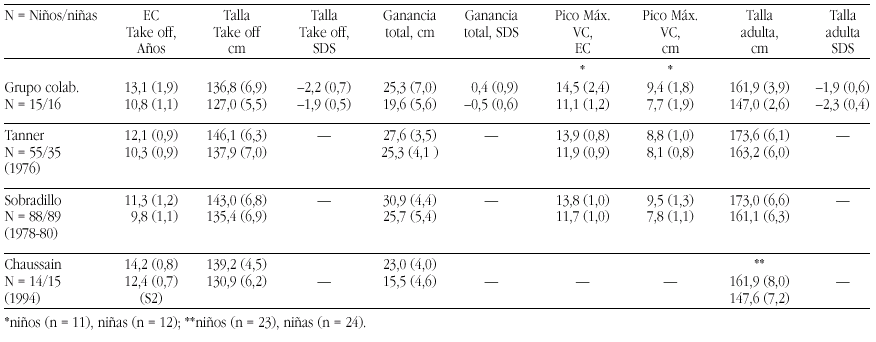
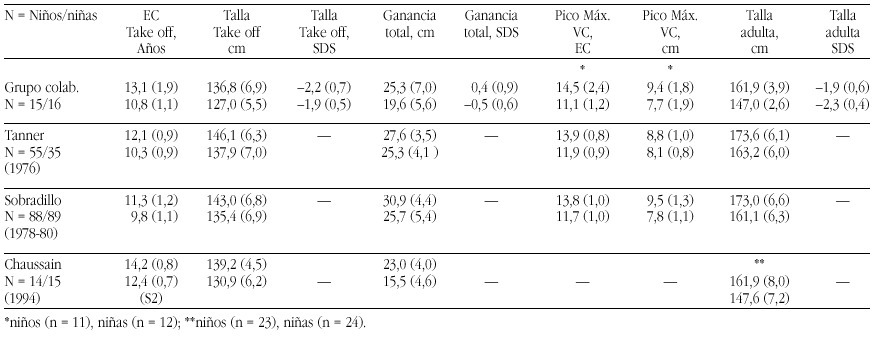
En definitiva, el método que ofrece más confianza para confirmar una deficiencia leve de zinc en niños sería el de su administración en concentraciones fisiológicas y constatar como consecuencia una respuesta positiva en su crecimiento. La evidencia de una respuesta positiva ha sido constatada por muy diferentes autores principalmente en países no desarrollados, pero también en los desarrollados10,21 (tabla 4). Hasta se llegó a proponer que en los niños con talla baja en los que no se hallara una causa endocrina que justifique la situación se les administrase zinc durante seis meses, aunque en ellos se demuestren unas concentraciones séricas dentro de límites normales11. Por lo demás, incluso en aquellos casos en que se observó una ausencia de efecto de la suplementación, puede constatarse un aumento de la velocidad de crecimiento, si bien no se atribuiría al zinc19.
En España en este momento se observa que la presencia de elementos traza como el zinc y el hierro tiende a disminuir, por lo que es probable que existan casos en que los requerimientos no estén debidamente cubiertos22 (tabla 5). Aún así, consideramos que no existe justificación para aportar suplementos indiscriminados.
Probablemente merezca la pena considerar que algunos datos discordantes con respecto a la respuesta a la administración de zinc, principalmente en relación con países no desarrollados, se podrían deber a la existencia de otras deficiencias de nutrientes asociadas. En algunos trabajos se constató que los niños se beneficiaron más del tratamiento que las niñas, lo que podría deberse a que los primeros tienen unos mayores requerimientos.
Zinc y desarrollo
Desde los estudios de Hurley y Swenerton23 se estableció claramente que el zinc juega un papel en el desarrollo del sistema nervioso. En tal sentido, el zinc intervendría en diferentes situaciones, tales como la actividad sináptica, la neurotransmisión y la función enzimática. Después se han ido acumulando estudios de animales y también en humanos que avalan la influencia del zinc a nivel del desarrollo psicomotor. Es necesario reconocer que la mayoría de los estudios realizados en niños adolecen de rigor24. Aún así, si a las conclusiones extraídas de estos trabajos añadimos las persuasivas evidencias derivadas de la investigación animal, existe bastante fundamento para pensar que la deficiencia de zinc afecta al comportamiento de los niños24. También parece claro que es necesario llevar a cabo más estudios a efectos de determinar las características de la población que se podría beneficiar del tratamiento con zinc, la precisa naturaleza de los beneficios y la duración del tratamiento.
Hierro
El hierro fue el primer nutriente esencial que se reconoció para los animales en 1860. Aunque la información de que disponemos con respecto a él es más importante que la existente para cualquier otro oligoelemento, aún quedan muchas preguntas y problemas sin resolver.
La función más importante del hierro es la de transportar y almacenar oxígeno. Más del 80% del hierro corporal está contenido en la hemoglobina de los eritrocitos. Este elemento tiene también toda otra serie de funciones de carácter no hematológico y que se relacionan con el metabolismo de otros tejidos, como son los sistemas nervioso, muscular, inmune y gastrointestinal.
El hierro de la dieta existe como hierro heme, que se encuentra en la hemoglobina y mioglobina (una proteína heme, que sirve como un reservorio de oxígeno dentro del músculo), y como hierro no heme. Alrededor del 40% del hierro de la carne se encuentra en la forma heme, que es altamente absorbible. Aunque la leche materna tiene un contenido de hierro bajo, la absorción a partir de ella es casi del 50%, mientras que sólo es de un 10% para la leche de vaca. Esta es una de las razones por lo que no se recomienda esta última en forma no modificada hasta el año de edad. El hierro de los cereales se absorbe mal (alrededor de un 1%) y, para compensar esto, los cereales para lactantes se refuerzan con hierro. Aparecerá una deficiencia de hierro cuando se retrase indebidamente la introducción de la alimentación complementaria más allá de los 3-4 meses de edad o ante una dieta pobre en alimentos con hierro. El National Research Council, Food and Nutrition Board establece las recomendaciones de ingesta de hierro en aproximadamente 6 mg/día en lactantes, 10 mg/día en niños, 15 mg/día para adolescentes mujeres y 12 mg/día para adolescentes hombres6. La deficiencia de hierro tiene una especial prevalencia en los países no desarrollados y se asocia, como ya indicamos, con un aporte inadecuado (tabla 6). Constituyen un factor de riesgo adicional las pérdidas gastrointestinales debidas a la diarrea crónica y a los parásitos25.
El diagnóstico de la deficiencia de hierro se confirma con el hemograma, la extensión de sangre periférica y otros estudios complementarios (tabla 7). El VCM debe considerarse un buen parámetro, ya que sufre pocas variaciones técnicas y biológicas. Su disminución constituye una alerta muy sensible de la deficiencia de hierro. En aquellos casos en que la concentración de hemoglobina y el VCM se encuentran en la zona baja del intervalo normal es muy probable que el niño tenga una deficiencia leve26.
Por lo que respecta a los efectos de la deficiencia de hierro sobre el crecimiento no disponemos de estudios consistentes, en gran medida derivado de la dificultad de poder delimitar la influencia de otros factores, tales como la edad, enfermedades intercurrentes, malnutrición general y el peso al nacer10. Lo que si está bien establecido es que la carencia de este mineral puede afectar el desarrollo motor y mental24,27 (fig. 2). Los niños con anemia ferropénica presentan un elevado riesgo de sufrir alteraciones del comportamiento y un peor desarrollo tanto en el momento de presentarla como a largo plazo24.
Cobre
Alrededor del 90% del cobre del organismo se encuentra en los músculos, huesos, cerebro e hígado. Numerosas funciones bioquímicas del cobre se deben a que forma parte de varias metaloenzimas tales como la citocromo c oxidasa, un componente esencial de la cadena respiratoria mitocondrial, la lisil oxidasa, una enzima clave en la maduración del colágeno, la dopamina hidroxilasa, que cataliza la síntesis de dopamina, la tiroxina oxidasa, una enzima clave en la biosíntesis de la melanina, la superóxido dismutasa citosólica, implicada en el sistema de defensa antioxidante celular, la amino oxidasa, una enzima fundamental en el catabolismo de la histamina y de otras moléculas relacionadas y la ceruloplasmina, la proteína fundamental para el transporte tisular de cobre hasta los tejidos e implicada asimismo en la oxidación de hierro para que pueda ser captado por la transferrina. Las manifestaciones clínicas de la deficiencia de cobre se explican principalmente en términos de alteración enzimática.
La leche humana contiene 200-400 mg/L de cobre y usualmente suministra al lactante desde 50 mg/kg/día en los primeros días de vida postnatal hasta 13 mg/kg/día después de seis meses de lactancia, aunque hay otras estimaciones que sugieren una menor ingesta. El equilibrio en la homeostasia del cobre se consigue cuando los lactantes reciben una cantidad diaria de 27 mg/kg/día a partir de la leche materna, si bien no se han observado problemas clínicos asociados a la deficiencia en un rango de ingesta de 15-30 mg/kg/día. Las recomendaciones fijadas para la ingesta diaria se incrementarían desde los 75 mg/kg/día en los lactantes hasta los 1,0-1,5 mg/día en los adolescentes28. El cobre se almacena en el hígado y, por lo tanto, la deficiencia se presenta lentamente. No se ha informado de deficiencias en humanos sanos que consumen una dieta variada. La carencia en niños se ha asociado con el consumo de leche de vaca en las primeras etapas de la lactancia como alimento exclusivo, destete precoz, bajo peso al nacer, malnutrición y aumento de pérdidas gastrointestinales producidas por enfermedad diarreica (tabla 8).
Los estudios realizados en animales muestran que la deficiencia de cobre se asocia con retraso de crecimiento, pero no conocemos datos en humanos que demuestren una recuperación significativa de la talla tras el tratamiento de la deficiencia. En los humanos los signos clínicos de la deficiencia de cobre incluyen anemia hipocrómica, neutropenia, hipopigmentación del pelo y de la piel, formación anormal del hueso con aparición de fragilidad del esqueleto y osteoporosis, anomalías vasculares y pelo acerado. También puede producir enfermedad sistémica del hueso en niños prematuros29.
Se ha sugerido que la deficiencia de cobre podría afectar al desarrollo del sistema nervioso central. Se considera que la base de tal alteración estaría en que en condiciones normales se encuentran elevadas concentraciones a nivel de algunas estructuras neuronales, principalmente en los ganglios basales10. En estudios realizados en ratas con deficiencia de cobre se observó que la repleción del elemento condiciona un efecto favorable sobre el crecimiento corporal y el peso del cerebro. Estos hechos podrían ayudar a explicar el denominado síndrome de Menkes (tabla 9), que se debe a la alteración de un gen que codifica una proteína de membrana del retículo endoplásmico y que origina retraso mental y muerte, normalmente, antes de los tres años. El efecto inmediato del déficit genético es una menor absorción intestinal de cobre que se acumula en la metalotioneina de las células de la mucosa impidiendo su paso al hígado y posteriormente a la circulación sistémica, lo que origina retraso de crecimiento, defectos esqueléticos y degeneración neuronal. En esta enfermedad los niveles plasmáticos de cobre son extremadamente bajos. Por lo que respecta a estudios conducentes a valorar el posible efecto de la deficiencia adquirida postnatal sobre el desarrollo psicomotor hay que resaltar que no se han llevado a cabo.
Otros minerales traza
Manganeso
Las funciones bioquímicas del manganeso son la representación de una historia incompleta ya que el rango de defectos encontrados durante la deficiencia experimental en animales sugiere que existe una variedad de funciones dependientes de este metal aún por descubrir2. El manganeso es un constituyente de varias enzimas y activador de otras muchas. En los animales la deficiencia de este elemento da lugar a un pobre crecimiento, incapacidad para estar de pie o en posición supina y causa hinchamiento y desorganización del retículo endoplásmico, así como defectos en la membrana mitocondrial. No existe evidencia por lo que respecta a los humanos de que este tipo de alteración tenga repercusión sobre el crecimiento10. En ratones con metabolismo del manganeso genéticamente alterado se encuentra que el metabolismo de la dopamina está alterado. En ellos, la suplementación con este mineral conduce a una mejoría de la función neurológica30. Por lo que respecta a los humanos no hay, sin embargo, evidencias que permitan identificar un cuadro clínico característico.
Selenio
No existen datos que relacionen la deficiencia de selenio con afectación de crecimiento. Sin embargo, puede condicionarlo de una forma indirecta, ya que este mineral participa en el metabolismo de las hormonas tiroideas (fig. 3). El selenio constituye un componente esencial de muchas selenoproteínas que regulan la síntesis de las hormonas tiroideas, preservan la integridad de la glándula tiroidea en condiciones de acusado estrés oxidativo y controlan el metabolismo de la hormona a nivel de los tejidos no tiroideos31. Entre ellas tenemos las tironina-5'-deyodinasas, que están implicadas en la síntesis de las hormonas tiroideas sulfatadas. Existen tres tipos. La tipo I cataliza la conversión de T4 a T3 en la glándula tiroidea, hígado y riñón y es responsable de la mayor parte de la T3 en la corriente sanguínea; el papel fisiológico de esta enzima se comprende ya que es inhibida por propiltiouracilo, un fármaco que produce deficiencia de hormona tiroidea sin inhibir a las deyodinasas tipo II y III.
La deyodinasa tipo II actúa también en la posición 5' del anillo fenólico y cataliza la conversión de T4 en T3; se encuentra en la glándula tiroidea, la hipófisis, el sistema nervioso central y el músculo esquelético. Cuando el tiroides es estimulado, esta enzima adquiere importancia en la formación de T3; su función fisiológica es captar T4 de la corriente sanguínea y convertirla a T3 en el tejido diana. Esta enzima es única en el sentido de que tiene dos átomos de selenio en lugar de uno como las otras metaloenzimas que contienen este elemento.
La deyodinasa tipo III sólo actúa sobre el anillo tirosilo y cataliza la conversión de T4 a T3 inversa y de T3 a T2. El papel fisiológico de esta enzima es proteger el cerebro de posibles efectos tóxicos de un exceso de hormona T3.
Aunque la actividad deyodinasa se encuentra relativamente conservada en condiciones marginales de disponibilidad de selenio, sin embargo los actuales niveles encontrados en Europa podrían comprometer el metabolismo de la hormona tiroidea32. Por otro lado, la combinación de deficiencia de yodo y selenio exacerba el hipotiroidismo y puede condicionar una situación de cretinismo mixedematoso, tal como se ha observado en el Zaire.
Yodo
La deficiencia nutricional de yodo es todavía prevalente en muchas áreas del mundo. El término bocio ha sido utilizado durante muchos años para describir el efecto pri mario de la carencia. A causa de los avances en el conocimiento en relación con el déficit de este elemento es por lo que se ha introducido la denominación de enfermedades por deficiencia de yodo (EDY). La falta de un aporte adecuado de este elemento constituye la causa más habitual de minusvalía mental evitable (tabla 10). Toda la patología relacionada con tal situación resulta prevenible. Aunque se han puesto en marcha programas de suplementación de yodo en varios países desde 1924, las EDY siguen siendo un importante problema de salud a nivel planetario. Según datos del International Council for Control of lodine Deficiency Disorders, se encuentran en peligro de padecer esta deficiencia 1,6 millones de personas a nivel mundial; las enfermedades por deficiencia de yodo afectan a 50 millones de niños y cada año nacen 100.000 cretinos. La deficiencia de yodo sigue siendo un problema de salud pública en muchos países del mundo, incluyendo parte de Europa, pero muy especialmente afecta al este de Europa y a Asia.
La consecuencia fundamental de la deficiencia de yodo es la disminución de la síntesis y liberación de hormonas tiroideas, que conduce a una disminución de su concentración. Esto estimula el mecanismo de retroalimentación, que provoca un aumento de la secreción de tirotropina (TSH) hipofisaria. Este estado de hiperestimulación por la TSH conduce a una estimulación del metabolismo del yodo y al crecimiento del tejido tiroideo y desarrollo de bocio.
Además del bocio, la deficiencia de yodo en el hombre tiene una gran variedad de efectos sobre el crecimiento y desarrollo, que como señalamos, actualmente se engloban bajo la denominación de EDY (tabla 11).
La definición de cuáles son las necesidades fisiológicas de yodo no es sencilla, siendo éste un tema muy discutido. Un consenso, que incluye al Food and Nutrition Board of the National Academy of Sciences of the United States, la Academia Americana de Pediatría, la Sociedad Europea de Gastroenterología Pediátrica y Nutrición, y la Comisión de las Comunidades Europeas, estableció las recomendaciones que se indican en la fig. 433.
Los métodos para realizar la suplementación del yodo se pueden dividir en dos amplias categorías: las medidas diseñadas para aplicarse a toda la población (sal, pan o agua yodados) y las medidas dirigidas a grupos específicos, como pueden ser las mujeres en edad de procrear y los niños hasta que alcanzan la pubertad. La medida más habitualmente usada ha sido la de la sal yodada. Las concentraciones recomendadas de yodo en la sal y las directrices para vigilar su oportunidad y eficacia se refieren en la publicación Micronutrient Series de la Organización Mundial de la Salud: WHO/NUT/96.13. Para llegar a tales recomendaciones se han tenido en cuenta las siguientes informaciones:
- La pérdida de yodo de la sal desde el lugar en que se produce hasta la casa en que se consume, es de alrededor del 20%.
- Durante el proceso de cocinado se calcula que hay otro 20% de pérdida.
- La ingesta media de sal por persona y día se calcula en l0 g.
Así, para que el individuo ingiera 150 mg de yodo/día, la sal debe contener en el punto de producción entre 20 y 40 mg de yodo (o 34-36 mg de yodato potásico) por kilo de sal. Cuando se yoda toda la sal, incluida la que se emplea en la preparación de los alimentos procesados, se reco mienda que la cantidad a añadir sea de 20 mg. En estas circunstancias la excreción urinaria de yodo variaría entre 100 y 200 mg/L.
Como conclusión de todo lo expuesto, consideramos que conviene resaltar que la complejidad de los estudios propia de los sistemas dinámicos continúa comprometiendo los esfuerzos dirigidos a tratar de comprender el metabolismo mineral en relación con el crecimiento y el desarrollo. Estudios in vitro usando técnicas moleculares nos ofrecen la promesa de una interpretación más profunda de los hechos, si bien la posibilidad de extrapolar esta información al organismo en su totali