La displasia broncopulmonar (DBP) es la enfermedad pulmonar crónica más frecuente en niños prematuros. Con la introducción de corticoides prenatales, la administración de agente tensioactivo y las nuevas estrategias de ventilación mecánica, se ha incrementado la supervivencia de neonatos cada vez más inmaduros, por lo que la incidencia de la DBP no sólo no ha descendido, sino que ha aumentado en este grupo de niños nacidos extremadamente pretérmino. Condiciona una gran morbilidad respiratoria en los 2–3 primeros años de vida, con numerosos ingresos hospitalarios y agudizaciones respiratorias provocados en su mayoría por infecciones víricas. Aunque hay una tendencia hacia la mejoría, en la edad escolar y la adolescencia persisten los síntomas respiratorios, así como alteraciones en la función pulmonar, y con cierta frecuencia estos niños presentan menor capacidad para el ejercicio.
Aunque los síntomas de la DBP son muy parecidos a los del asma, ya que existe limitación al flujo aéreo e hiperrespuesta bronquial (HRB), el mecanismo fisiopatológico podría ser distinto en las 2 enfermedades.
Por otra parte, la prematuridad aislada desempeña un papel importante en la enfermedad respiratoria crónica del niño y ya desde los primeros meses de vida se demuestran alteraciones en la función pulmonar de niños pretérmino sanos. Se ha observado que estos niños también tienen mayor morbilidad respiratoria que los nacidos a término no sólo en los primeros años de vida, sino en edades posteriores.
En este artículo analizaremos distintos aspectos de la enfermedad respiratoria crónica asociada a la prematuridad, deteniéndonos en la sintomatología clínica, las alteraciones de la función pulmonar, la HRB y la capacidad de ejercicio. Haremos un recorrido desde la primera infancia hasta la adolescencia y la edad adulta joven. También veremos las similitudes y las diferencias entre la DBP y el asma.
Bronchopulmonary dysplasia (BPD) is the most frequent chronic lung disease in premature children. With the inclusion of antenatal steroid therapy, surfactant use and novel mechanical ventilation strategies, survival of premature newborns has increased, whereupon the incidence of BPD has not only decreased but has also risen in extremely premature newborns. This has led to a high respiratory morbidity in the first 2–3 years of life, with numerous admissions to hospital and respiratory exacerbations mostly due to viral infections. Although there is a trend towards improvement, during school age and adolescence, respiratory symptoms may persist, due to changes in pulmonary function often showing a lower exercise capacity.
Although BPD symptoms are similar to those of asthma, as there is limitation in airflow and bronchial hyperresponsiveness (BHR), pathophysiological mechanisms could be different in both diseases.
On the other hand, isolated prematurity plays an important role in the child's respiratory pathology, proving that pulmonary function alterations in preterm children are present since the first months of life. A higher respiratory morbidity has also been observed in these children when compared to full-term newborns, not only during the first years of life but also subsequently.
In this study, different aspects of chronic respiratory disease associated with prematurity will be analysed, drawing special attention to clinical symptoms, respiratory function changes, BHR and exercise capacity. All these aspects will be reviewed from early childhood until adolescence and young adult age. Similarities and differences between BPD and asthma will also be discussed.
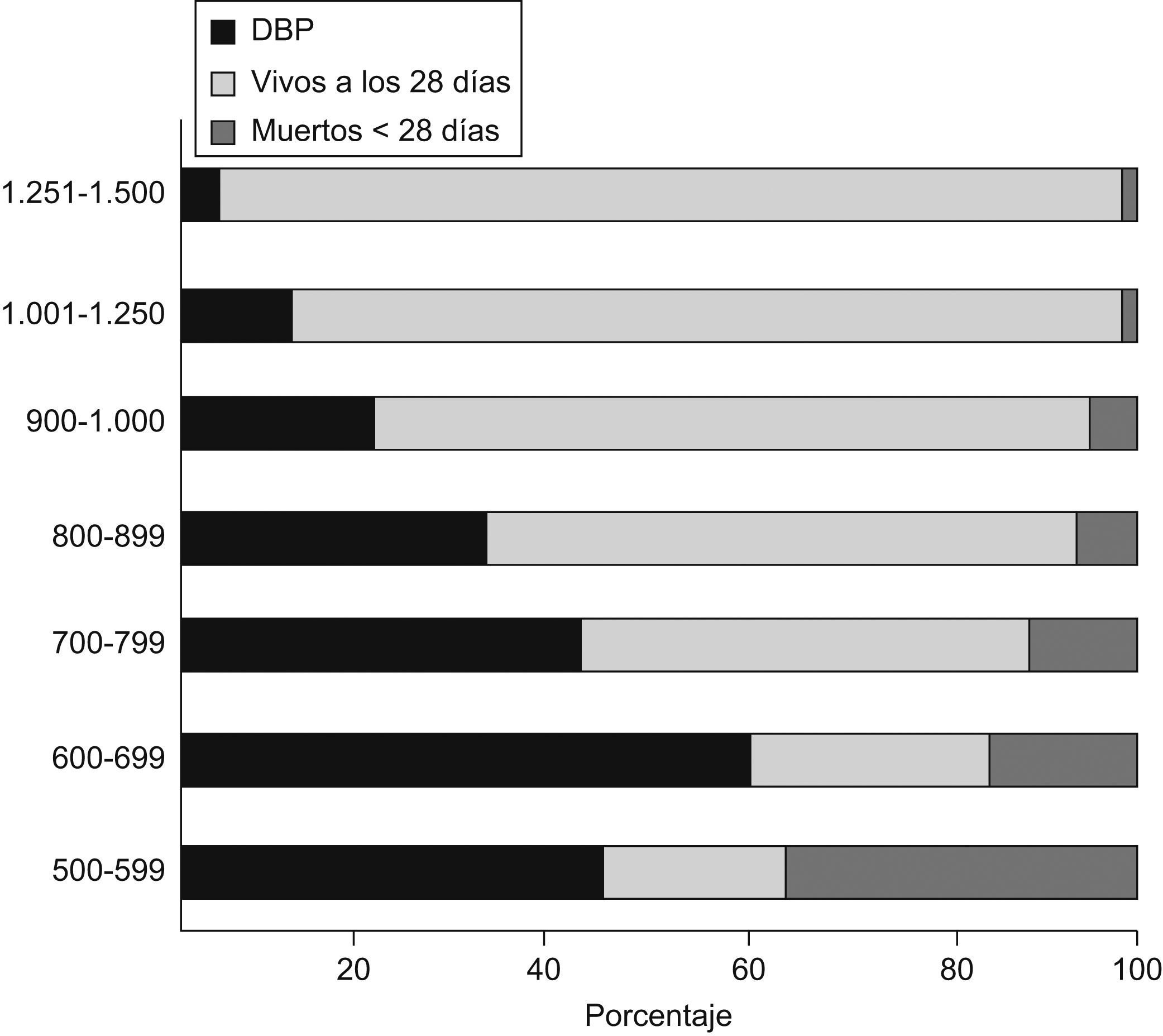
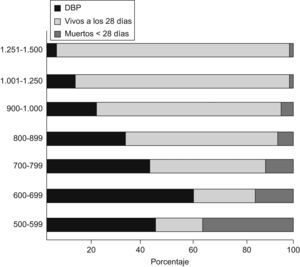
La displasia broncopulmonar (DBP) es la enfermedad pulmonar crónica más frecuente en los niños prematuros que sobreviven a los 28 días de vida. Northway et al1 describieron en 1967 los hallazgos clínicos, radiológicos y patológicos de esta enfermedad: ocurría en niños nacidos pretérmino con síndrome de distrés respiratorio (SDR) que habían necesitado concentraciones elevadas de oxígeno y ventilación mecánica (VM) prolongada, lo que resultaba en inflamación, fibrosis e hipertrofia del músculo liso de las vías aéreas. A pesar de los avances en la prevención y el tratamiento del SDR (uso generalizado de esteroides prenatales y tratamiento con agente tensioactivo) así como del mejor manejo de la VM (control del baro y el volutrauma, menores concentraciones de oxígeno, hipercapnia permisiva, uso de presión positiva continua en la vía aérea nasal, etc.), la DBP es una de las mayores complicaciones de los niños prematuros. Todos estos avances han conseguido disminuir la incidencia de la DBP en niños mayores de 1.500g. Sin embargo, con la mayor supervivencia de niños muy inmaduros (24–26 semanas de gestación, peso al nacer<1.000g) que tienen más riesgo de desarrollar la enfermedad, la incidencia global de ésta ha permanecido igual o incluso ha aumentado, aunque existen grandes variaciones entre unos centros y otros. Claramente, el riesgo de desarrollar DBP se incrementa a medida que disminuyen el peso al nacer o la edad gestacional. Se estima, en general, que la incidencia en menores de 1.000g es alrededor de un 30%. Datos más recientes revelan una incidencia que varía desde un 52% en niños con peso entre 501 y 750g hasta un 7% en niños con peso entre 1.251 y 1.500g, pero es muy infrecuente en niños con peso superior a 1.500g y gestación superior a 30 semanas2,3 (fig. 1).
Supervivencia neonatal e incidencia de la displasia broncopulmonar (DBP) según el peso al nacer3.
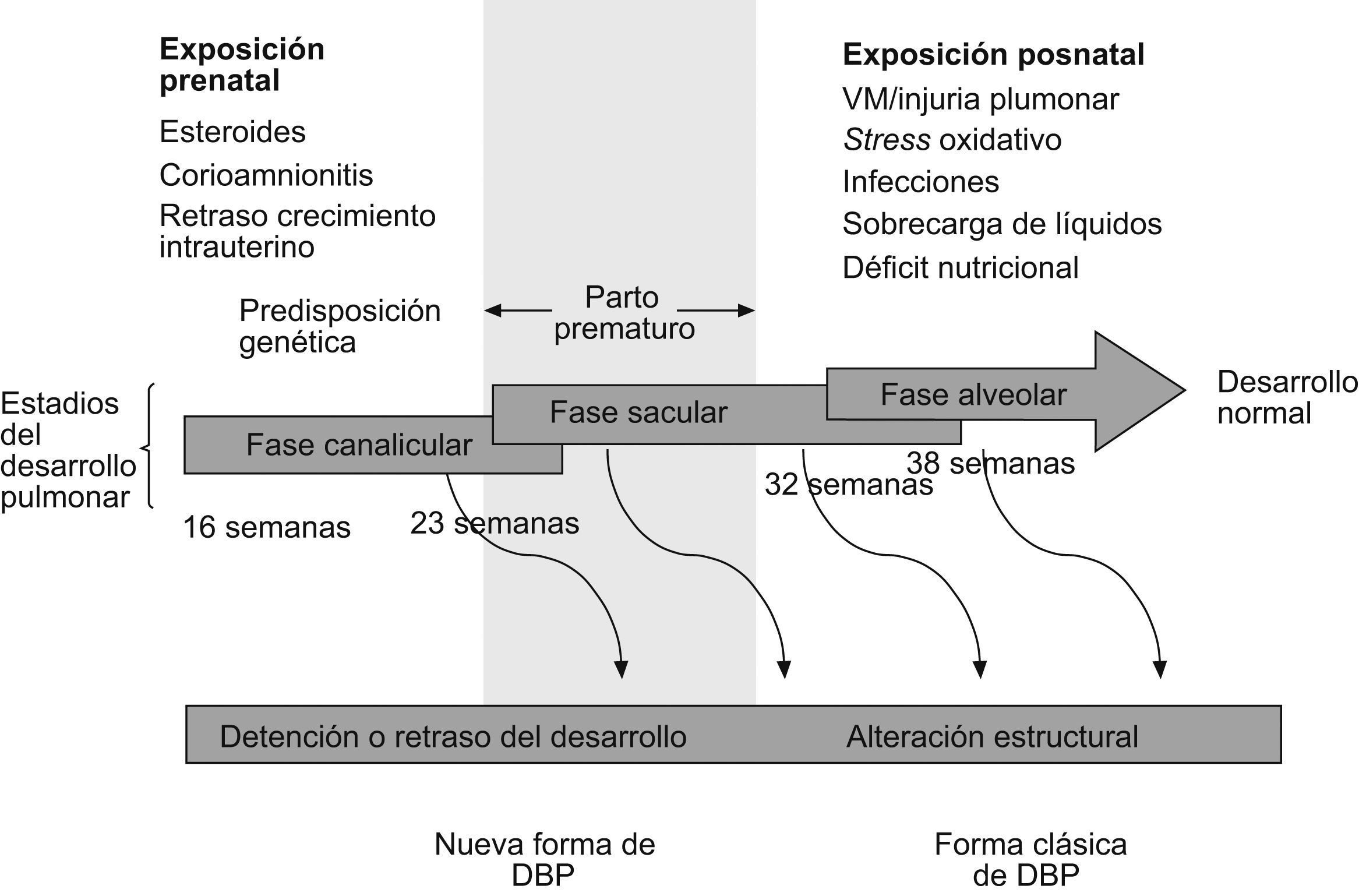
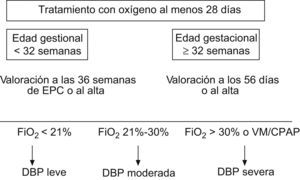
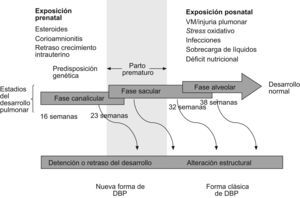
Desafortunadamente, las distintas definiciones usadas en el pasado han contribuido a una gran variabilidad entre los numerosos estudios publicados, lo que hace difícil conocer realmente el alcance de la enfermedad y sus verdaderas secuelas (tabla 1)3. En los últimos años parece existir consenso y la DBP se define como la necesidad de suplemento de oxígeno al menos 28 días después del nacimiento, y su gravedad dependerá del grado de soporte respiratorio requerido al llegar cerca del término (fig. 2)4.
Variación en la incidencia de la displasia broncopulmonar en 492 niños con peso inferior a 1.000g, según la definición utilizada3
| Necesidades de O2 | Porcentaje |
| O2 continuo durante los primeros 28 días | 5,9 |
| O2 a los 28 días de vida | 57,2 |
| O2≥28 días durante la hospitalización | 47,1 |
| O2 a las 36 semanas de edad corregida | 25,0 |
| O2 a las 36 semanas de edad corregida y ≥28 días | 22,8 |
O2: oxígeno.
El diagnóstico de DBP identifica a una serie de pacientes prematuros que van a tener un riesgo incrementado de secuelas respiratorias5. Aunque sería previsible pensar que la prolongada dependencia de oxígeno condicionaría un peor pronóstico a largo plazo, no siempre ocurre así, y la realidad es que no existe ningún marcador claro de daño pulmonar crónico; encontramos niños con DBP que con el paso de los años se van recuperando clínica y funcionalmente y, por otra parte, niños pretérmino que sin haber necesitado ningún tipo de soporte respiratorio en el período neonatal, tienen anormalidades respiratorias en los siguientes años.
Daño pulmonarLa enfermedad pulmonar de la DBP en la era preagente tensioactivo se caracterizaba por la presencia de inflamación en la vía aérea, hipertrofia del músculo liso y fibrosis del parénquima. Todo se debía a los efectos de altas concentraciones de oxígeno y al uso de VM intensiva en niños con SDR6,7. Este modelo de DBP es el que se conoce como “DBP clásica”. Hoy en día, como hemos comentado anteriormente, la introducción de medidas para prevenir el SDR (corticoides prenatales y administración de agente tensioactivo) y los cambios en el cuidado ventilatorio de los niños (menores concentraciones de oxígeno, hipercapnia permisiva, menores presiones inspiratorias, etc.) han conseguido que esta forma clásica de DBP se reduzca considerablemente. Pero la supervivencia de niños cada vez más inmaduros ha condicionado la aparición de otro tipo de daño pulmonar, que es el llamado “forma nueva de DBP”. Esta enfermedad, en realidad, es un trastorno en el desarrollo pulmonar (los niños nacen entre las 23–28 semanas de gestación, en la fase canalicular del pulmón), y en contraste con los niños que desarrollan formas graves de DBP, los que tienen las “formas nuevas” inicialmente pueden requerir concentraciones de oxígeno bajas o moderadas y escaso soporte ventilatorio; sin embargo, debido a la inmadurez del pulmón, cualquier exposición mínima a una noxa (infección, persitencia del ductus, sobrecarga de líquidos, etc.) afectará al proceso normal de crecimiento y al desarrollo tanto de los alvéolos como de los vasos pulmonares. Los hallazgos patológicos en los pulmones de niños con las “formas nuevas” de DBP son muy diferentes de los encontrados en las “formas clásicas” (tabla 2). Los cambios histológicos representan la lesión del pulmón en una fase muy precoz de su desarrollo, por lo que el patrón histopatológico predominante es una detención en el desarrollo alveolar (fig. 3)8. En modelos animales se ha demostrado no sólo reducción en el número de alvéolos, sino también aumento de los espacios aéreos, con disminución de la superficie alveolar y, por tanto, alteración del recambio gaseoso. Tanto las grandes como las pequeñas vías aéreas muestran menos metaplasia epitelial, menos hipertrofia del músculo liso y menos fibrosis comparados con los pulmones de los niños con DBP clásica, en los que alternan zonas de atelectasia con sobredistensión. En niños que han muerto con DBP se observa, además de una falta de alveolarización, una reducción importante del lecho vascular pulmonar. Hay evidencias que apoyan la “hipótesis vascular”, según la que la disrupción de la angiogénesis en períodos críticos del crecimiento pulmonar puede afectar a la alveolarización y contribuir a la hipoplasia pulmonar (características ambas de la DBP)9. Estas anormalidades persisten durante meses en babuinos pretérmino expuestos a altas concentraciones de oxígeno y a VM10.
Diferencias histopatológicas entre las formas nuevas y las formas clásicas de displasia broncopulmonar
| Forma clásica |
|
| Forma nueva |
|
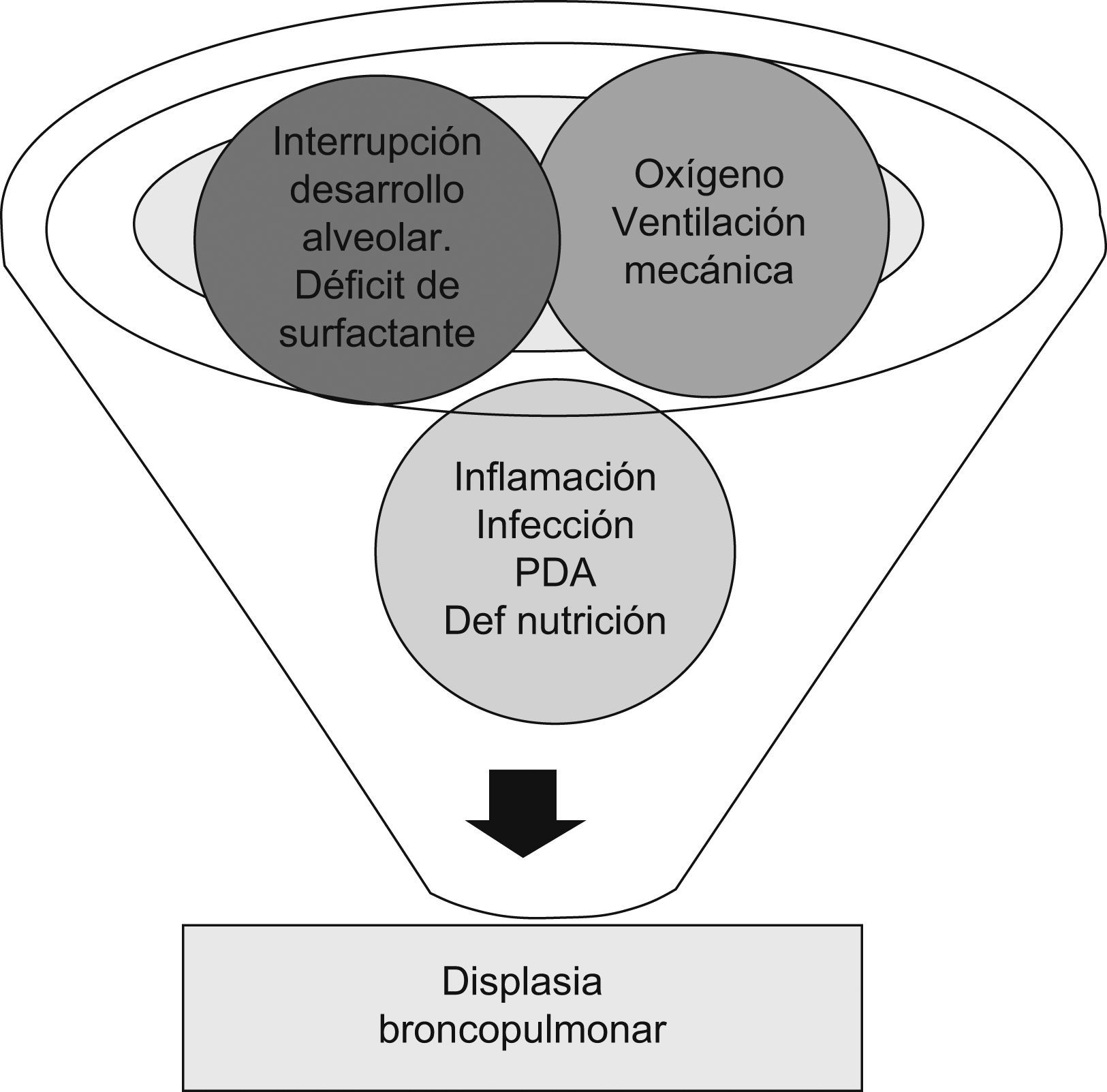
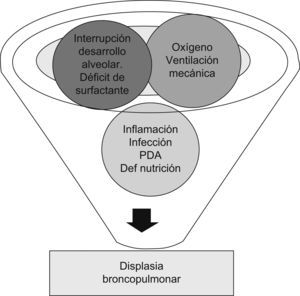
La necesidad de VM incrementa el riesgo de daño pulmonar tras el parto prematuro, no sólo por el efecto de los radicales libres del oxígeno, sino por la exposición a grandes volúmenes y a picos inspiratorios, lo que provocará no sólo anomalías en el epitelio respiratorio, sino que puede también inducir una alteración en la formación y el desarrollo del alvéolo. El proceso de reparación del sistema respiratorio, conocido como “remodeling”, ocurre en diferentes estructuras pulmonares, incluyendo el epitelio, la matriz extracelular, la musculatura lisa y la secreción de moco. Esto condicionará los hallazgos patológicos característicos de la DBP11. No obstante, esta enfermedad tiene un origen multifactorial, pues aunque los factores más implicados son la VM y las altas concentraciones de oxígeno, hay muchos otros que, al incidir en un pulmón inmaduro, van a tener un papel importante en la patogénesis de ésta (fig. 4). La herencia y la susceptibilidad genética pueden influir en la expresión de genes que son importantes para el desarrollo vascular, la síntesis del agente tensioactivo y la regulación del proceso inflamatorio, y seguramente estos factores desempeñen un importante papel en las formas nuevas de DBP12.
Evolución clínica y funcional de la displasia broncopulmonarTras haber conocido las características patológicas del pulmón inmaduro, es difícil saber con certeza qué papel desempeñan la prematuridad, el bajo peso, la enfermedad respiratoria neonatal o el tratamiento empleado en la posterior evolución respiratoria de los niños prematuros con DBP, ya que, como veremos más adelante, la prematuridad per se constituye un factor de riesgo para el desarrollo de enfermedad crónica respiratoria más allá del período neonatal. La DBP representaría el extremo de un espectro de daño pulmonar inducido por la prematuridad y por una serie de episodios prenatales y posnatales.
Morbilidad respiratoriaDurante los primeros años de vida existe mayor morbilidad respiratoria en los niños de muy bajo peso o nacidos pretérmino, sobre todo si tienen DBP. Existe un mayor riesgo de sibilancias recurrentes así como una mayor susceptibilidad a las infecciones respiratorias de las vías bajas, sobre todo víricas. La rehospitalización por enfermedad respiratoria es común entre los niños con DBP menores de 2 años. Incluso los que aparentemente se recuperan bien de ésta tienen un alto riesgo de ingresos hospitalarios por enfermedades intercurrentes en esos 2 años de vida. Este riesgo se incrementa si los niños siguen teniendo síntomas persistentes de DBP; las infecciones de las vías aéreas inferiores son la principal causa de ingreso, suelen ir asociadas la mayoría de las veces a sibilancias y a exacerbación de su enfermedad respiratoria de base.
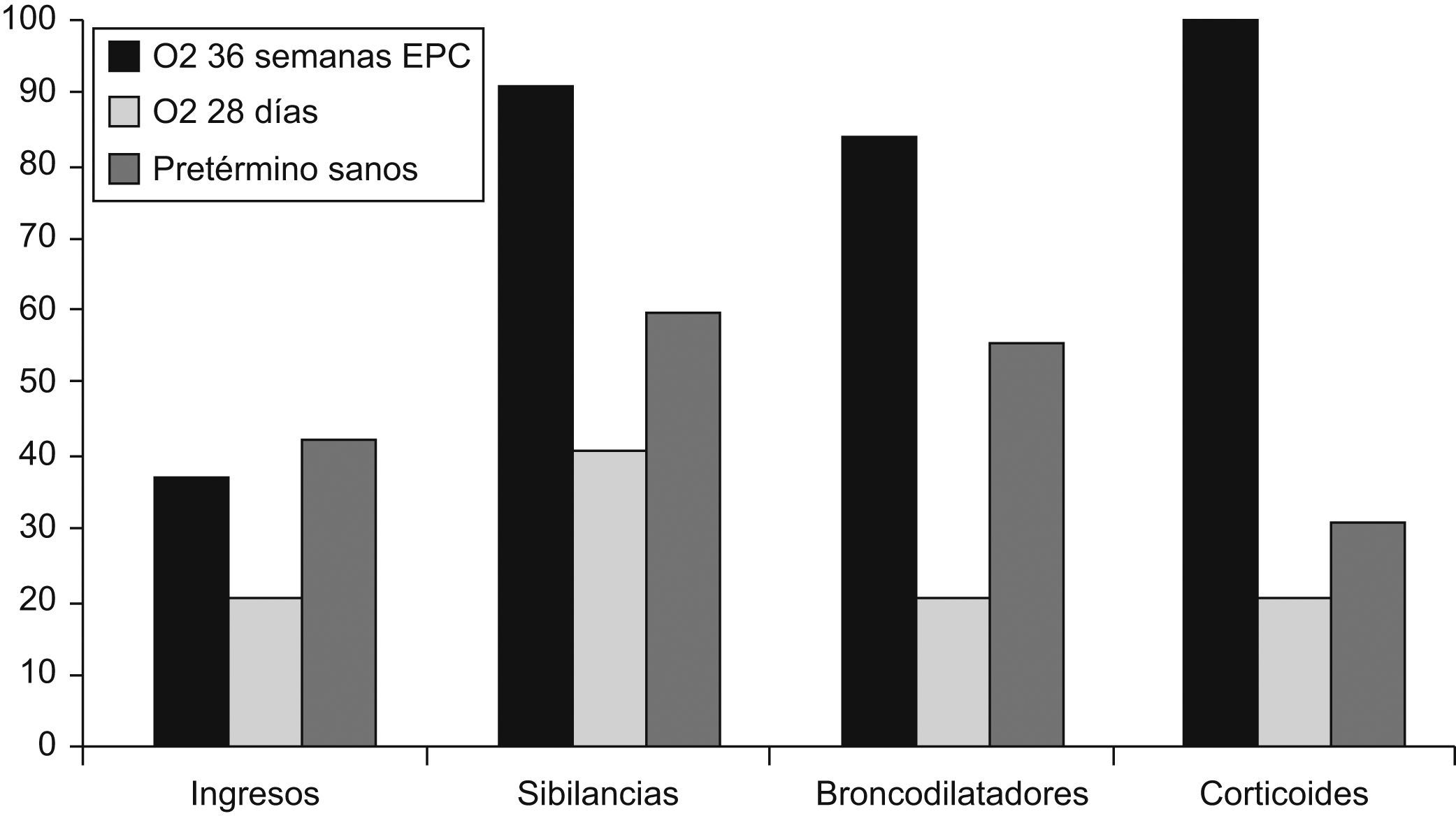
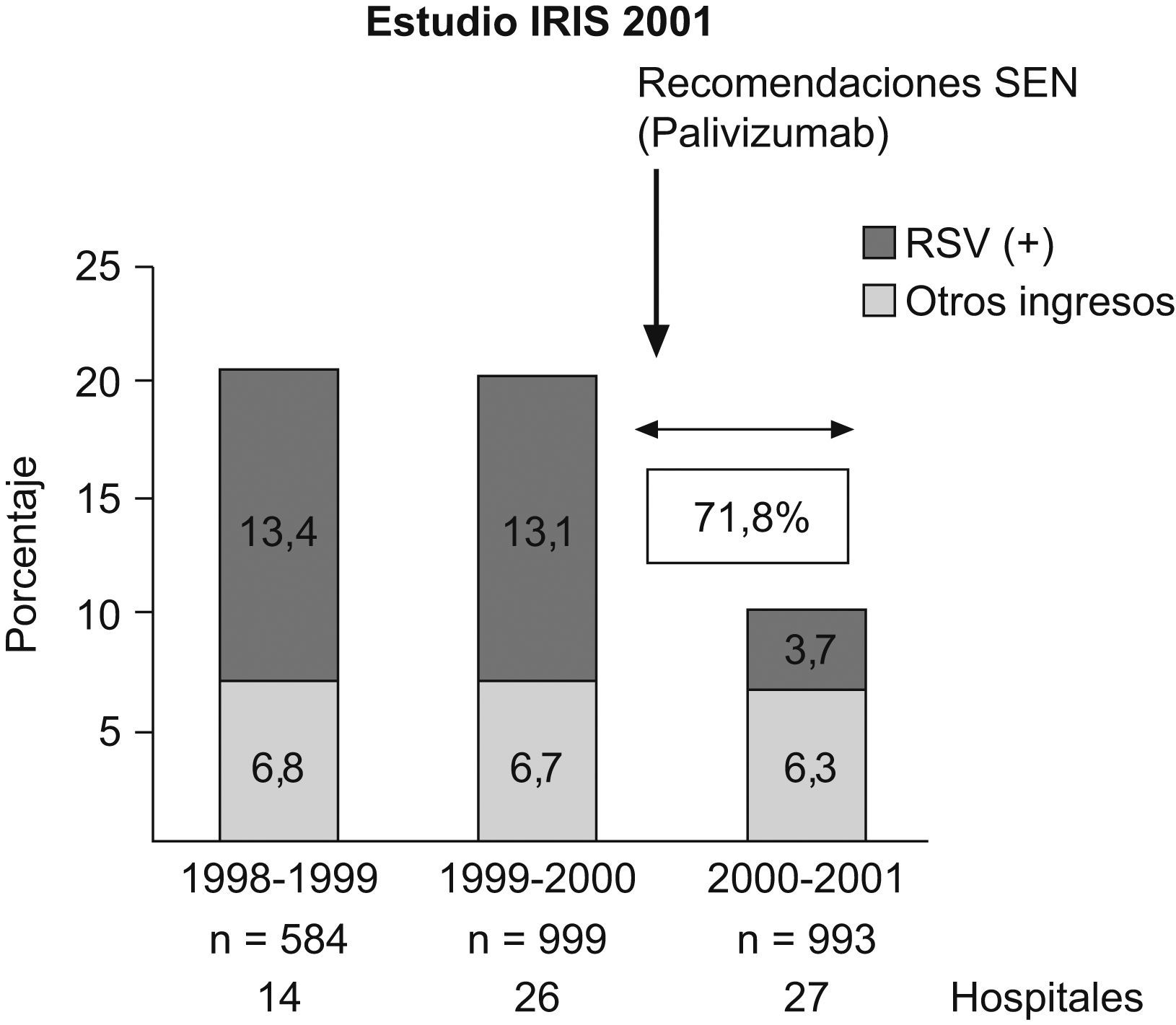
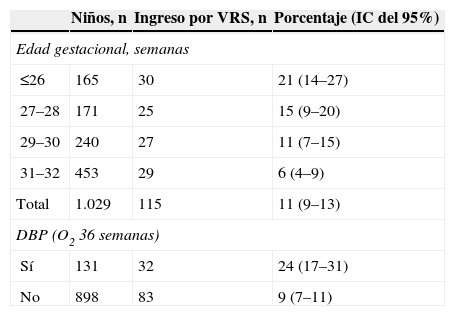
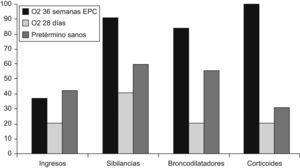
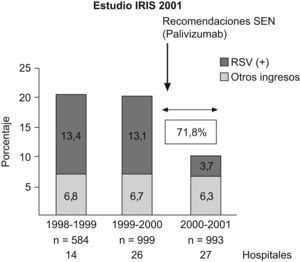
En el primer año de vida, según Smith et al13, se hospitalizó al 49% de los niños con DBP frente al 23% de los pretérmino sin DBP y, después de analizar factores como la exposición al tabaco, la profilaxis frente al virus respiratorio sincitial (VRS), la lactancia materna y la calidad del aire ambiental, concluyeron que la DBP fue el principal factor de riesgo para la rehospitalización de niños prematuros en ese primer año de vida. Furman et al14, en un seguimiento de 98 niños con DBP desde el nacimiento hasta los 2 años de edad, comprobaron que el 50% reingresó durante el primer año de vida y el 37% durante el segundo año de vida. Los episodios de sibilancias, las neumonías y las infecciones por VRS fueron los causantes del 65% de los ingresos en el primer año y del 81% de los ingresos en el segundo año. La gravedad de la DBP estuvo asociada a la mayor estancia hospitalaria. Las cifras variaban según se considerara la DBP como necesidad de oxígeno a los 28 días o a las 36 semanas de edad gestacional; esto último era lo más predictivo de la evolución respiratoria de estos niños15–17 (fig. 5). Los factores ambientales y la exposición al tabaco pueden incrementar el riesgo de problemas respiratorios en estas edades18. En general, se estima que el 80% tendrá alguna infección de las vías respiratorias bajas en el primer año de vida y alrededor de un 50% requerirá ingreso hospitalario19,20. El riesgo de hospitalización debido a infección por VRS se encuentra entre el 11 y el 13% en los pretérmino menores de 32 semanas, y coincide con el estudio IRIS realizado por la Sociedad Española de Neonatología21, pero este riesgo aumenta a medida que disminuyen el peso al nacer y la edad gestacional y, sobre todo, si los niños desarrollan DBP22,23. La gravedad de la infección también está relacionada con la menor edad gestacional y, por supuesto, con la existencia o no de DBP (tabla 3). Recientemente se ha comprobado que los prematuros que tuvieron una infección sintomática de las vías respiratorias bajas por VRS o morbilidad respiratoria tras ésta tenían peor función respiratoria antes del alta de la unidad neonatal24. La utilización de anticuerpos monoclonales (palivizumab) para la profilaxis del VRS ha supuesto un importante avance en el descenso de la infección por este virus (fig. 6)25, con la consiguiente reducción en el número de hospitalizaciones26.
Variación en la morbilidad respiratoria durante los 2 primeros años según el criterio utilizado para el diagnóstico de la displasia broncopulmonar16.
Riesgo de hospitalización por el virus respiratorio sincitial en niños prematuros según edad gestacional y necesidades de oxígeno23
| Niños, n | Ingreso por VRS, n | Porcentaje (IC del 95%) | |
| Edad gestacional, semanas | |||
| ≤26 | 165 | 30 | 21 (14–27) |
| 27–28 | 171 | 25 | 15 (9–20) |
| 29–30 | 240 | 27 | 11 (7–15) |
| 31–32 | 453 | 29 | 6 (4–9) |
| Total | 1.029 | 115 | 11 (9–13) |
| DBP (O2 36 semanas) | |||
| Sí | 131 | 32 | 24 (17–31) |
| No | 898 | 83 | 9 (7–11) |
DBP: displasia broncopulmonar; IC: intervalo de confianza; O2: oxígeno; VRS: virus respiratorio sincitial.
Evolución de los ingresos debidos a infección por VRS en 27 hospitales españoles antes y después de la utilización de palivizumab (niños prematuros ≤32 semanas)25.
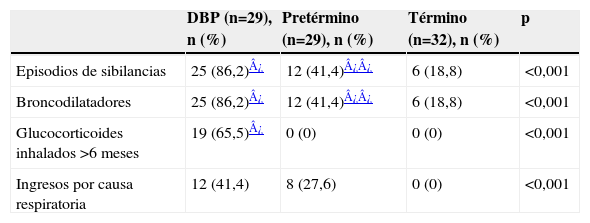
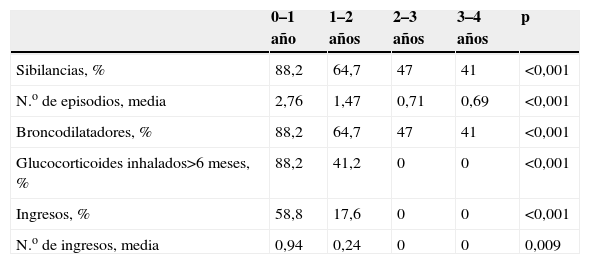
A partir de los 3–4 años de vida, las hospitalizaciones por problemas respiratorios decrecen27,28; sin embargo, incluso a partir de los 4–5 años, los niños con DBP tienen algún síntoma de disfunción respiratoria. En nuestra experiencia, tras un seguimiento longitudinal durante 2 años a niños con peso inferior a 1.500g con y sin DBP, al compararlos con un grupo control de niños nacidos a término pudimos comprobar una mayor morbilidad en los niños prematuros y, especialmente, en los afectados de DBP (tabla 4)29. A partir de los 2 años de edad, disminuyeron el número de hospitalizaciones, los episodios de sibilancias y la necesidad de broncodilatadores, pero no llegaron a desaparecer por completo. A los 4 años, un porcentaje no despreciable de niños seguía teniendo síntomas respiratorios (tabla 5)29. Gross et al27 observaron que, en los 2 primeros años de vida, el 53% de los niños con DBP requirió hospitalización por causa respiratoria frente al 26% del grupo de prematuros sin DBP y al 3% de los controles nacidos a término. A los 7 años, ambos grupos de niños pretérmino tuvieron con más frecuencia sibilancias y tos crónica que los controles; sin embargo, los valores espirométricos relacionados con el flujo espiratorio, tanto el flujo espiratorio en el primer segundo (FEV1) como el flujo espiratorio forzado entre el 25 y el 75% de la capacidad vital (FEF25–75), sólo estaban descendidos en los niños con DBP y había poca diferencia entre los pretérmino sin DBP y los controles. Aproximadamente un tercio de los niños pretérmino con y sin DBP estudiados por Vrijland et al30 tenía síntomas como sibilancias o disnea a los 3–5 años, y casi la mitad de ellos había usado betaadrenérgicos en el último año. En general, en la edad escolar, los niños pretérmino con o sin DBP van a tener síntomas respiratorios y diagnóstico de asma con más frecuencia que los niños nacidos a término31.
Morbilidad respiratoria en niños pretérmino en los 2 primeros años de vida29
| DBP (n=29), n (%) | Pretérmino (n=29), n (%) | Término (n=32), n (%) | p | |
| Episodios de sibilancias | 25 (86,2)¿ | 12 (41,4)¿¿ | 6 (18,8) | <0,001 |
| Broncodilatadores | 25 (86,2)¿ | 12 (41,4)¿¿ | 6 (18,8) | <0,001 |
| Glucocorticoides inhalados >6meses | 19 (65,5)¿ | 0 (0) | 0 (0) | <0,001 |
| Ingresos por causa respiratoria | 12 (41,4) | 8 (27,6) | 0 (0) | <0,001 |
DBP: displasia broncopulmonar.
Morbilidad respiratoria en niños con displasia broncopulmonar en los primeros 4 años de vida29
| 0–1 año | 1–2 años | 2–3 años | 3–4 años | p | |
| Sibilancias, % | 88,2 | 64,7 | 47 | 41 | <0,001 |
| N.o de episodios, media | 2,76 | 1,47 | 0,71 | 0,69 | <0,001 |
| Broncodilatadores, % | 88,2 | 64,7 | 47 | 41 | <0,001 |
| Glucocorticoides inhalados>6 meses, % | 88,2 | 41,2 | 0 | 0 | <0,001 |
| Ingresos, % | 58,8 | 17,6 | 0 | 0 | <0,001 |
| N.o de ingresos, media | 0,94 | 0,24 | 0 | 0 | 0,009 |
Es lógico pensar que el grado de gravedad de la DBP va a influir en la evolución de estos niños y, de hecho, así es en los primeros años de vida, aunque también influirá en la función pulmonar después de esos primeros años32. De hecho, Greenough et al33 valoraron la morbilidad respiratoria y los recursos sanitarios utilizados entre los 2 y los 4 años en una serie de 190 niños con DBP y encontraron que los niños que habían requerido oxigenoterapia domiciliaria tras el alta neonatal y, por tanto, la gravedad de su DBP era mayor, tuvieron más enfermedad respiratoria, hicieron más consultas al pediatra y al especialista y tuvieron más prescripciones de medicamentos que el grupo sin oxígeno domiciliario.
En niños mayores y adolescentes hay menos unanimidad en cuanto a la morbilidad respiratoria, además, son más escasos los estudios de los que disponemos. En una serie estudiada por Halvorsen et al32, los adolescentes con antecedentes de prematuridad, con o sin DBP, tuvieron más síntomas respiratorios que los nacidos a término. En otro estudio realizado en 508 adultos de 19 años nacidos prematuramente, un porcentaje elevado tuvo síntomas respiratorios equivalentes al asma, incluso los que no habían tenido DBP34. Sin embargo, hay autores35 que no encuentran diferencias en la situación respiratoria a la edad de 14 años entre prematuros y nacidos a término, aunque al realizarles pruebas de función pulmonar observan que los parámetros relacionados con el flujo aéreo (FEV1 y FEF25–75) son menores en el grupo con DBP que en los prematuros sin DBP, y éstos a su vez tienen valores más bajos que los controles nacidos a término.
En general, hay una tendencia hacia la mejoría clínica a medida que pasan los años36–38. Los síntomas respiratorios van disminuyendo progresivamente y la mayoría de los sujetos nacidos pretérmino pueden hacer, aparentemente, una vida normal. No obstante, la tos y las sibilancias serán algo más frecuentes que en la población general, así como los síntomas tras el ejercicio físico. A medida que los niños van creciendo, la relación entre los síntomas clínicos y la función pulmonar va desapareciendo, y se encuentran pacientes con escasos o nulos síntomas respiratorios que presentan alteraciones en la función pulmonar35.
¿Cómo evoluciona la función pulmonar?El análisis de los flujos espiratorios muestra una limitación importante al flujo aéreo en los primeros 3 años de vida39–41. Aunque hay estudios que muestran una mejoría progresiva entre el primer y el tercer año de vida, hay otros que demuestran que puede incluso deteriorarse durante el primer año. Hofhuis et al42, al medir la capacidad residual funcional (FRC) y el flujo máximo a FRC (V′max FRC) en niños muy inmaduros con DBP, encontraron valores reducidos a los 6 meses y empeoramiento a los 12 meses. Este empeoramiento reflejaba probablemente el efecto conjunto del daño pulmonar no resuelto más las interferencias relacionadas con la prematuridad en sí, todo ello en un momento en el que el niño crece muy rápido. Baraldi y Filippone41,43 mostraron que los lactantes que a los 10–20 días de vida tenían menor compliance respiratoria también tenían valores más bajos de flujos espiratorios a la edad de 2 años. Al estudiar a los niños más adelante, comprobaron que también existía correlación entre los valores del V′max FRC medido a los 2 años y las cifras del FEV1 y de los flujos mesoespiratorios (FEF25–75) en años posteriores, e indicaron que la alteración de la función pulmonar persiste más allá de los 3 primeros años de vida. Tepper et al39, al comparar a niños prematuros con y sin DBP con niños a término a la edad de un año, encontraron que los pacientes con DBP tenían una reducción significativa de la capacidad vital forzada (FVC) y de los flujos espiratorios a esa edad, con mejoría de la FVC posteriormente, pero que el flujo espiratorio permanecía al 50% de la normalidad todavía a los 17 meses. Este estudio coincidió con otro, en el que se observó una mejoría evidente de la FVC durante los 3 primeros años, que incluso llegó a la normalidad, pero persistía una obstrucción importante de la vía aérea en todos los pacientes con DBP moderada y grave44. Podríamos deducir de estos estudios que el crecimiento del parénquima pulmonar va más o menos paralelo al crecimiento del niño debido a la multiplicación alveolar, mientras que la función de la vía aérea no crece al mismo ritmo.
La disfunción de la vía aérea mantenida en el tiempo refleja la gravedad de la enfermedad respiratoria neonatal ya que, aunque hay estudios que no han encontrado correlación entre los valores de los flujos espiratorios en lactantes con DBP y la duración de la VM o de la oxigenoterapia en el período neonatal40,41, las medidas pulmonares mecánicas que reflejan la gravedad de la enfermedad neonatal sí se han correlacionado bien con alteración posterior de la función pulmonar en niños preescolares. Talmaciu et al45 encontraron que los niños con DBP que aún requerían suplemento de oxígeno después de los 2 años de edad tuvieron los parámetros relacionados con el flujo más bajos que los que no necesitaban oxígeno. En cuanto a los volúmenes pulmonares, al estudiarlos por pletismografía en los niños con DBP, demostraron que aunque la capacidad pulmonar total (TLC) era normal, la FRC, el volumen residual (RV) y el cociente RV/TLC estaban elevados al año de edad. Estos hallazgos indican también una obstrucción significativa de las vías aéreas y un atrapamiento aéreo en el primer año de vida40,46.
Efectos de la prematuridad en las alteraciones de la función pulmonarTras estudiar la función pulmonar tanto en los primeros años como más adelante, se ha ido observando que aunque los niños con DBP son los que tienen mayor afectación de la función pulmonar, los pretérmino “sanos”, o sea, sin enfermedad respiratoria neonatal, también muestran peor función pulmonar y mayor morbilidad respiratoria que los niños nacidos a término. Ante esto, se han realizado numerosos estudios en los primeros meses de vida para valorar la importancia que tiene la prematuridad per se en la alteración de la función pulmonar. Recordemos que la vía aérea está completamente formada a las 16–18 semanas de gestación durante la fase seudoglandular, que los alvéolos no comienzan su desarrollo hasta después de la semana 28 durante la fase sacular y que sólo el 30% del número total de alvéolos del adulto está formado al llegar al término. Las vías respiratorias continúan creciendo después del parto, doblan su diámetro y triplican su longitud hasta la edad adulta, pero no aumentan en número; sin embargo, los alvéolos siguen creciendo tanto en número como en tamaño, sobre todo en los 2 primeros años de vida.
Hjalmarson y Sandberg47 midieron la función pulmonar de niños pretérmino “sanos” cuando llegaron al término y la compararon con la de niños nacidos a término. Los pretérmino tuvieron moderada reducción en la FRC y en la eficiencia de la mezcla de gases, probablemente por la afectación en el desarrollo de las unidades terminales respiratorias. Yuksel y Greenough48 encontraron un incremento de la resistencia de la vía aérea en prematuros sanos a los 6 y a los 20 meses de edad. Otros 2 estudios han evaluado los flujos espiratorios máximos en prematuros durante su primer año de vida. En uno de ellos49 no se encontró una reducción significativa en el V′max FRC a las 2–3 semanas de nacer en prematuros sanos al compararlos con controles nacidos a término, pero sí se encontró una disminución significativa de este flujo cuando evaluaron a los niños al año de edad. Por el contrario, Friedrich et al50, usando técnicas distintas, encontraron flujos espiratorios reducidos ya en el primer mes de vida en 62 niños menores de 37 semanas asintomáticos, e indicaron que incluso sin enfermedad respiratoria neonatal ni daño por soporte ventilatorio los niños pretérmino tienen una reducción innata en los flujos máximos espiratorios, lo que reforzó la hipótesis de que la prematuridad per se desempeña un papel importante en el desarrollo de la obstrucción de la vía aérea. De forma interesante, estos mismos autores51 encontraron que a los 2 años persistían reducidos los flujos y la FVC era normal; el incremento de los parámetros de función pulmonar fue proporcional al crecimiento somático y similar entre prematuros y los niños a término, lo que indica que el “catch-up” en la función pulmonar no tiene lugar en los primeros 2 años de vida, como sería lógico pensar teniendo en cuenta el rápido crecimiento del pulmón en esos 2 años. Gappa et al52 presentaron datos de prematuros con y sin DBP de 3 países europeos (Inglaterra, Alemania y Holanda) en los que existía función pulmonar reducida al año de edad, independientemente del modo de ventilación durante el período neonatal. Estos autores coinciden con Jobe53 en que posiblemente el pulmón de estos niños va creciendo a un ritmo distinto al de sus vías aéreas, y cada vez parece más evidente que la reducción de la función pulmonar que sigue tras el parto pretérmino está relacionada con anormalidades en el desarrollo, independientemente de la gravedad de la enfermedad inicial y de los efectos del tratamiento ventilatorio empleado, y condiciona un riesgo incrementado de enfermedad respiratoria en los primeros años de vida en estos niños. Aunque todavía hay muchas lagunas en la comprensión del crecimiento y el desarrollo pulmonar y de la respuesta del sistema respiratorio a insultos precoces, todo lo expuesto anteriormente nos reafirma que los cuidados prenatales y la prevención de la prematuridad serán tan importantes para la salud respiratoria a largo plazo como las nuevas mejoras en la ventiloterapia durante el período neonatal.
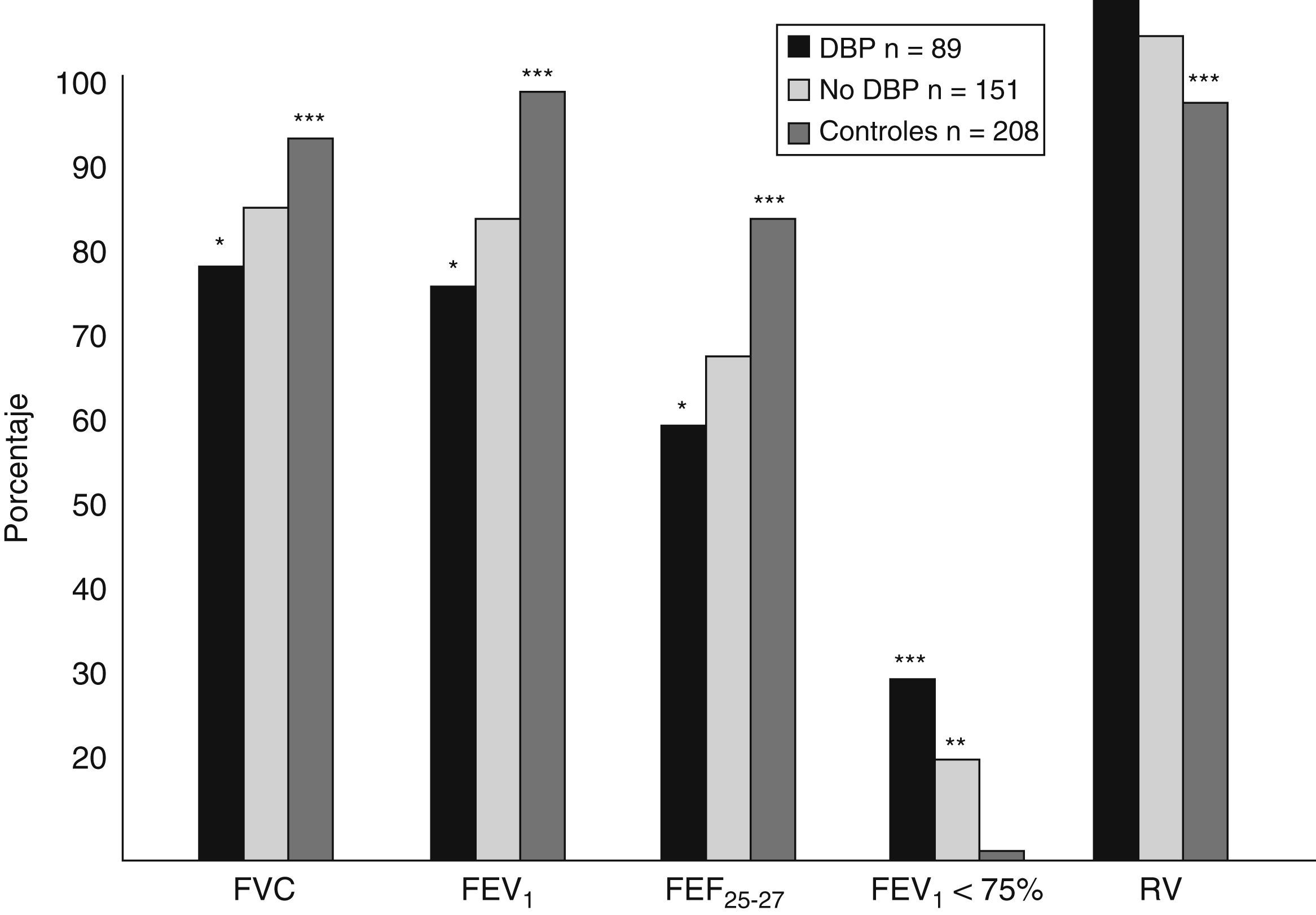
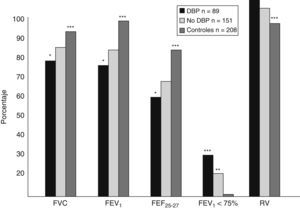
¿Qué ocurre con la función pulmonar cuando el niño va creciendo?Numerosos estudios evalúan los efectos de la prematuridad y la DBP en la función pulmonar de los niños en edad escolar. Hakulinen et al37 analizaron la morbilidad respiratoria y la función pulmonar en 72 niños cuando tenían entre 6 y 9 años de edad; de ellos, 42 eran pretérmino y dentro de este grupo había 10 niños que habían tenido DBP, 19 necesitaron VM en el período neonatal pero no desarrollaron DBP, y 13 no tuvieron DBP ni necesitaron VM. El resto (30 niños) habían nacido a término sin ninguna enfermedad. El 40% de los niños con DBP tuvo sibilancias recurrentes hasta los 6 años y el 50% tuvo algún ingreso por causa respiratoria, también en este grupo se encontraron valores más bajos de conductabilidad específica y valores más elevados de FRC y RV. El grupo de niños prematuros que necesitó VM en el período neonatal tuvo menos sibilancias a los 6 años y menores tasas de hospitalización que el grupo con DBP, pero más que las de los otros 2 grupos. En este estudio no se encontró alteración de la función pulmonar en los pretérmino sanos. Doyle54 estudió la función respiratoria en 240 niños australianos a la edad de 8 años, nacidos con edad gestacional inferior a 30 semanas y peso inferior a 1.000g, y la comparó con la de un grupo control de 208 niños de la misma edad nacidos a término. Los parámetros relacionados con el flujo aéreo estaban significativamente disminuidos en el grupo de niños pretérmino y de muy bajo peso comparados con los del grupo control. Además, el porcentaje de niños con el FEV1 inferior al 75% fue del 19% en los pretérmino frente al 2,4% en los nacidos a término (p<0,0001). En el grupo de los pretérmino, los que habían tenido DBP en el período neonatal y los que más tarde tuvieron sibilancias tenían reducidos significativamente los parámetros relacionados con el flujo aéreo (fig. 7). El 24,7% de los pretérmino tuvo síntomas compatibles con asma y alteraciones de la función pulmonar (55 demostraron que a los 10 años persistían las anomalías funcionales relacionadas con los flujos espiratorios en niños nacidos con peso inferior o igual a 1.500g, tuvieran o no DBP. En 1993, Rona et al56 observaron que cada semana extra de gestación reduce el riesgo de sibilancias tardías en un 10% y encontraron disminución de los flujos espiratorios en niños prematuros en la edad escolar, independientemente de la enfermedad respiratoria neonatal.
Función pulmonar en 240 niños pretérmino a la edad de 8 años54.
Como vemos, aunque es difícil comparar unos estudios con otros debido a las distintas edades gestacionales de los niños estudiados, a los distintos grupos control, a las distintas definiciones de DBP utilizadas en cada uno y a los distintos cuidados perinatales de cada centro, hay una serie de conceptos que parecen estar claros: los niños en edad escolar con una historia de DBP tienen menor FEV1 que los niños nacidos pretérmino sin enfermedad pulmonar, y éstos a su vez tienen este flujo más bajo que los nacidos a término. No hay diferencias en la TLC ni en la FRC en la edad escolar entre niños nacidos prematuramente con y sin DBP al compararlos con los nacidos a término, aunque el cociente RV/TLC que refleja el atrapamiento aéreo permanece más elevado en los niños con DBP que en el resto de los niños estudiados.
¿Qué ocurre en la adolescencia y la edad adulta?Aunque existe una mejoría de la función pulmonar a medida que van pasando los años57,58, hay estudios en los que se demuestra que aún en la adolescencia y en los adultos jóvenes pueden existir alteraciones de ésta. Northway et al5, 20 años después de describir la enfermedad, encontraron que tanto el FEV1 como el FEF25–75 y la FVC eran más bajos en los 26 adolescentes y adultos jóvenes diagnosticados de DBP en el período neonatal que en los 2 grupos control (prematuros sin DBP y nacidos a término). La resistencia de la vía aérea fue mayor, y la conductabilidad específica fue más baja. El único factor de riesgo que encontraron para esta alteración de la función pulmonar fue la DBP, pero no encontraron asociación con el peso al nacer, la edad gestacional ni ninguna otra variable neonatal. También tenían más sintomatología respiratoria (sibilancias, episodios de neumonía, uso de medicación inhalada, limitación al ejercicio, etc.) los del grupo con DBP que los otros 2 grupos. Doyle et al59 estudiaron la función pulmonar en la adolescencia tardía en 147 sujetos con antecedentes de prematuridad y comprobaron que persistían las alteraciones de la función pulmonar en los que tuvieron DBP, y que en este grupo, además, existía un deterioro de ésta entre los 8 y los 18 años. Los pretérmino sin DBP en su conjunto tenían función pulmonar dentro de los rangos normales, pero existía alguna reducción en las variables relacionadas con los flujos espiratorios. Anand et al38 observaron que a los 15 años los niños que habían nacido con menos de 1.500g tenían con más frecuencia tos crónica, sibilancias y asma que el grupo de niños nacidos con peso normal y, al realizarles estudio de función pulmonar, encontraron obstrucción de las medianas y pequeñas vías respiratorias. En esta serie no hubo diferencias importantes en la función pulmonar entre los que necesitaron soporte respiratorio en el período neonatal y los que no lo necesitaron. En otra serie de 46 niños con menos de 1.000g estudiados a los 17 años, Halvorsen et al32 concluyeron que el parto prematuro está asociado a mayor morbilidad respiratoria en esas edades y a alteraciones de la función pulmonar, pero los que tuvieron DBP muestran peores cifras en los parámetros espirométricos relativos al flujo espiratorio que el resto. La gravedad de la DBP influye de forma negativa en la función pulmonar.
Narang et al60, en un estudio longitudinal de la función pulmonar desde la infancia hasta la edad adulta en sujetos nacidos pretérmino, encontraron que a los 21 años persistían los síntomas respiratorios en un porcentaje considerable, pero no hallaron obstrucción de la vía aérea ni hiperrespuesta bronquial (HRB), lo que sí existía cuando estudiaron a esta misma población entre los 7 y los 9 años. Posiblemente la normalidad de la función pulmonar en esta muestra se debió al escaso número de sujetos con DBP y a la mayor edad gestacional (31,5 semanas frente a 28 semanas de la serie de Halvorsen, 30 semanas de la serie de Anand y 28 semanas de la serie de Doyle). La diferencia que existe en cuanto a la obstrucción de la vía aérea con la serie de Anand podría explicarse por las diferentes edades de los sujetos (15 frente a 21 años) y la posibilidad de que la función de la vía aérea continúe normalizándose más allá de la adolescencia, sobre todo en varones, en los que el desarrollo pulmonar y torácico no termina hasta el final de la pubertad61. Otro factor que hay que tener en cuenta es la diferencia entre las madres fumadoras en el estudio de Narang (14%) frente a las de la serie de Anand (45%). Por otra parte, Vrijlandt et al62 aportaron que a los 19 años los sujetos con antecedentes de prematuridad tenían valores espirométricos dentro del rango normal, pero estos valores eran más bajos que los del grupo control; en su serie había una mayor incidencia de DBP y una menor edad gestacional. Koumbourlis et al58, al estudiar a niños con antecedentes de DBP, encontraron descenso del FEF25–75 en el 50% de ellos, tanto a los 8 como a los 15 años. De éstos, la mayoría respondió a los broncodilatadores o tuvo un test de metacolina positivo, lo que indica que la obstrucción de las pequeñas vías aéreas está relacionada de algún modo con la HRB. El FEV1, la FVC, la TLC, el CV y la FRC fueron normales en ambas edades.
Como vemos, con el crecimiento parecen ir normalizándose los volúmenes pulmonares y, sin embargo, persisten ciertas anomalías en la función de las vías respiratorias, así como atrapamiento aéreo. Esto indica que el proceso de reparación del parénquima pulmonar no va paralelo al proceso de normalización de la vía aérea.
Hiperrespuesta bronquialAdemás de la alteración de los flujos espiratorios, los pretérmino con y sin DBP presentan con frecuencia HRB5,63,64.
Se estima que entre un 40 y un 60% de niños con historia de DBP tiene respuesta al ejercicio, a la histamina o a la metacolina. También se ha demostrado esta HRB en niños con antecedentes de prematuridad, aunque no hayan desarrollado DBP. No está claro el origen de la HRB (factores genéticos, lesión pulmonar ocurrida en el período neonatal o anomalías en el desarrollo de la vía aérea)64, pero en prematuros destinados a desarrollar DBP se ha confirmado ya a los 3 días de vida65. En una serie63 de 29 niños de entre 8 y 14 años, se comprobó que los valores espirométricos basales estaban más reducidos en los pretérmino con o sin DBP que en el grupo control, pero la dosis de histamina necesaria para reducir el FEV1 un 15% (PD15) fue más baja en el grupo con DBP que en los otros 2 grupos. Hubo una gran asociación entre los síntomas respiratorios y la HRB; de hecho, todos los niños con PD15 inferior a 1mg tenían síntomas respiratorios. Estos autores encontraron relación entre la PD15 y el tiempo de oxigenoterapia neonatal, por lo que indicaron que la HRB puede ser una secuela del daño de la vía aérea durante el tratamiento respiratorio neonatal. Halvorsen et al32, en su serie de adolescentes de 17 años, encontraron que la prevalencia de HRB a la metacolina fue mayor en los nacidos pretérmino (56%) que en los controles (26%), sin que existieran diferencias significativas entre pretérmino con y sin DBP.
Capacidad de ejercicioDurante el ejercicio, el gasto cardíaco puede incrementarse hasta 5 veces como resultado del incremento tanto de la frecuencia cardíaca como del volumen sistólico. La ventilación minuto puede incrementarse hasta 25 veces en individuos sanos dependiendo de la intensidad del ejercicio. La difusión del monóxido de carbono aumenta hasta un 50% durante el ejercicio debido al reclutamiento y a la distensión de los capilares pulmonares, particularmente los de las partes superiores del pulmón. En sujetos normales, la desigualdad ventilación-perfusión disminuye durante el ejercicio debido al incremento de la perfusión apical. Debido a que las limitaciones cardiopulmonares pueden no ser evidentes clínicamente mientras el niño está en reposo, los test de ejercicio son útiles en niños nacidos pretérmino y que han desarrollado DBP para determinar la presencia y la extensión de cualquier disfunción en la transferencia de gases secundaria al crecimiento alveolar anómalo. En cualquier sujeto que hace ejercicio, el consumo de oxígeno (VO2) aumentará linealmente con el incremento en la carga de trabajo, pero a la larga se alcanzará una meseta, donde nuevos incrementos en la carga de trabajo no incrementarán el VO2. Esto se define como VO2 máximo (VO2 máx) y es el mejor índice para valorar la capacidad aeróbica y la forma física cardiorrespiratoria. Está relacionado con la disponibilidad del oxígeno y da información sobre el metabolismo aeróbico en respuesta al estrés que supone el ejercicio. La ventilación minuto también se incrementa inicialmente de forma lineal, y también alcanza una meseta con el aumento de la carga de trabajo que se denomina “ventilación máxima minuto”. El umbral anaerobio (AT) se considera un indicador del inicio de la acidosis metabólica debida al aumento de ácido láctico durante el ejercicio66. Este índice parece ser el mejor indicador de la capacidad física, se relaciona bien con la capacidad de resistencia y, además, es relativamente independiente del máximo esfuerzo. Por tanto, los marcadores más importantes de la forma física y la capacidad de ejercicio serán el VO2 máx, la ventilación máxima minuto y el AT. El entrenamiento físico aumentará ambos: el VO2 y el AT.
Teniendo en cuenta la alteración de la función pulmonar, es de suponer que los niños nacidos pretérmino puedan tener a largo plazo alguna limitación para realizar ejercicio físico intenso y, de hecho, en ocasiones es el único síntoma que refieren al llegar a la edad escolar y a la adolescencia. Kilbride et al67 estudiaron la función pulmonar y realizaron el test de esfuerzo con tapiz rodante a 50 niños entre 9 y 15 años que habían nacido con un peso inferior a 801g (recién nacidos de muy bajo peso [RNMBP]), y los compararon con 25 niños que habían nacido con peso normal. El 20% de los RNMBP tuvo alteraciones en los parámetros de función pulmonar al compararlo con los teóricos de la población normal. Los niños con DBP, comparados con los RNMBP sin DBP, tuvieron valores significativamente más bajos de FEV1, FEF25–75 y FEF25–75/FVC. Tras el test de ejercicio, se encontró que los RNMBP con y sin DBP tuvieron menor VO2, menor VO2 al AT (VO2 máx) y menores cifras de SatO2 que los nacidos con peso normal. El tiempo que los niños toleraron el ejercicio fue también menor en los RNMBP que en los de peso normal; curiosamente, los padres de los niños pretérmino definieron a sus hijos menos activos que los nacidos a término. Otros autores también han encontrado broncoespasmo inducido por el ejercicio en los niños con DBP así como cifras más bajas de VO2 máx, alteraciones en la ventilación y mayor frecuencia respiratoria que en los controles, e indicaron capacidad aeróbica y ventilación reducidas68.
A los 17 años69, un grupo de nacidos pretérmino tuvo peor actitud física que los controles, como quedó reflejado en la capacidad aeróbica, la resistencia, la flexibilidad y el nivel de actividad. También era más frecuente el descenso de la SatO2 durante el ejercicio en niños con historia de DBP que en los controles, lo que puede estar relacionado con la reducción de la superficie alveolocapilar68,70.
En coincidencia con lo ya expuesto, un estudio prospectivo holandés62 (tabla 6) valoró los efectos a largo plazo de la prematuridad en pacientes de 19 años y encontró mayor obstrucción de la vía aérea y disminución en la capacidad de difusión de monóxido de carbono al compararlos con el grupo control, aunque los parámetros estaban dentro de los límites normales. Los nacidos pretérmino tienen un nivel de ejercicio más bajo que no puede explicarse por afectación de la función pulmonar ni tabaquismo, y posiblemente se deba a peor aptitud física. No encontraron diferencias entre los pretérmino con y sin DBP, aunque la muestra con la que valoraron a los niños con y sin DBP era muy pequeña. Recientemente, otros autores71 llegaron a conclusiones parecidas al estudiar a 126 niños con una edad media de 10 años y nacidos entre las 27 y las 34 semanas de gestación. Encontraron una afectación significativa de la capacidad de ejercicio a pesar de tener obstrucción de la vía aérea y atrapamiento aéreo leves. Afirmaron que la afectación de la función pulmonar no es tan importante como para justificar la menor capacidad de ejercicio. Consideraron que un programa de entrenamiento físico podría mejorar esa capacidad de ejercicio.
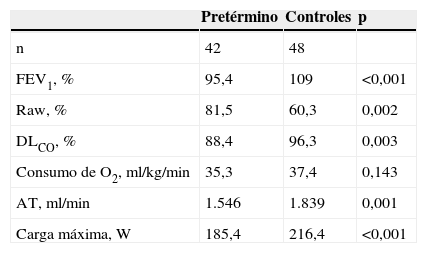
Función pulmonar y capacidad de ejercicio en 90 adultos jóvenes nacidos pretérmino62
| Pretérmino | Controles | p | |
| n | 42 | 48 | |
| FEV1, % | 95,4 | 109 | <0,001 |
| Raw, % | 81,5 | 60,3 | 0,002 |
| DLCO, % | 88,4 | 96,3 | 0,003 |
| Consumo de O2, ml/kg/min | 35,3 | 37,4 | 0,143 |
| AT, ml/min | 1.546 | 1.839 | 0,001 |
| Carga máxima, W | 185,4 | 216,4 | <0,001 |
AT: umbral anaeróbico; DLCO: difusión del monóxido de carbono; FEV1: flujo espiratorio en el primer segundo; O2: oxígeno; Raw: resistencia de la vía aérea.
Sin embargo, serán necesarios más estudios para conocer si los padres de los RNMBP restringen su actividad ante la percepción de cierta discapacidad o si los niños no participan en actividades físicas debido a limitaciones fisiológicas, que pueden ser particularmente importantes en el caso de la DBP.
Displasia broncopulmonar y asma, ¿tienen alguna relación?Debido a los síntomas semejantes a los del asma (la limitación al flujo aéreo y la HRB), en muchas ocasiones estos niños se etiquetan de asmáticos72 y, en ocasiones, se insiste en tratar con glucocorticoides inhalados cuando no hay evidencia que apoye esta práctica73. A diferencia de lo que ocurre en niños con asma, no se ha encontrado mayor prevalencia de atopia en los niños con DBP y, de hecho, la HRB de estos niños no se correlaciona en la mayoría de los estudios con fenotipo atópico5,32,74. Siltanen et al75, en un estudio realizado en Finlandia, valoraron la posible relación entre atopia, sibilancias y alteración de la función pulmonar en 72 niños pretérmino de 10 años, y los compararon con 65 niños de la misma edad nacidos a término (tabla 7). La prevalencia de sibilancias durante los 10 años en los pretérmino fue de un 43 frente a un 17% en los nacidos a término (p<0,001). En este último grupo, el 64% de los sibilantes tuvo atopia frente al 23% de los pretérmino. Los niños nacidos pretérmino tuvieron peor función pulmonar (patrón obstructivo) que los nacidos a término, y se observó una correlación entre sibilancias y afectación en la función pulmonar, pero no se encontró correlación con atopia. Por el contrario, la mayoría de los nacidos a término que tuvieron historia de asma tenían atopia. Observaron que a medida que pasaban los años, las sibilancias o los síntomas de asma iban disminuyendo en el grupo pretérmino más que en el grupo a término, y que los niños pretérmino que aún a los 10 años tenían sibilancias tenían más atopia que los que no tuvieron sibilancias a esta edad (el 62 frente al 9%). Esto los llevó a concluir que la predisposición atópica es un factor de riesgo para la persistencia de las sibilancias en prematuros más allá de los primeros años de vida. En la serie de niños de Mai et al en Suecia76, a los 12 años de edad los pretérmino tenían asma con doble frecuencia que los controles nacidos a término, y el suplemento de oxígeno en el período neonatal suponía un factor de riesgo para el desarrollo de asma. Además, la VM durante el período neonatal se asociaba a HRB a los 12 años. No encontraron ninguna relación entre la prematuridad y la atopia. Similares resultados obtuvieron Halvorsen et al77 al estudiar a 81 adolescentes con antecedentes de prematuridad y al compararlos con un grupo control. En el seguimiento se diagnosticó de asma a más sujetos del grupo pretérmino que del grupo control, y tuvieron cifras más bajas de FEV1 y mayor HRB. En este grupo, el asma y la HRB no tuvieron relación con factores hereditarios, atopia ni exposición al tabaco, como ocurrió en los asmáticos del grupo control; sin embargo, la HRB en los pretérmino se relacionó de forma significativa con DBP y requerimiento prolongado de oxígeno en el período neonatal.
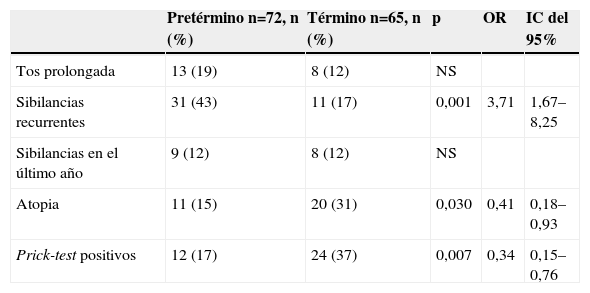
Síntomas respiratorios y atopia en niños pretérmino a los 10 años75
| Pretérmino n=72, n (%) | Término n=65, n (%) | p | OR | IC del 95% | |
| Tos prolongada | 13 (19) | 8 (12) | NS | ||
| Sibilancias recurrentes | 31 (43) | 11 (17) | 0,001 | 3,71 | 1,67–8,25 |
| Sibilancias en el último año | 9 (12) | 8 (12) | NS | ||
| Atopia | 11 (15) | 20 (31) | 0,030 | 0,41 | 0,18–0,93 |
| Prick-test positivos | 12 (17) | 24 (37) | 0,007 | 0,34 | 0,15–0,76 |
IC: intervalo de confianza; NS: no significativo; OR: odds ratio.
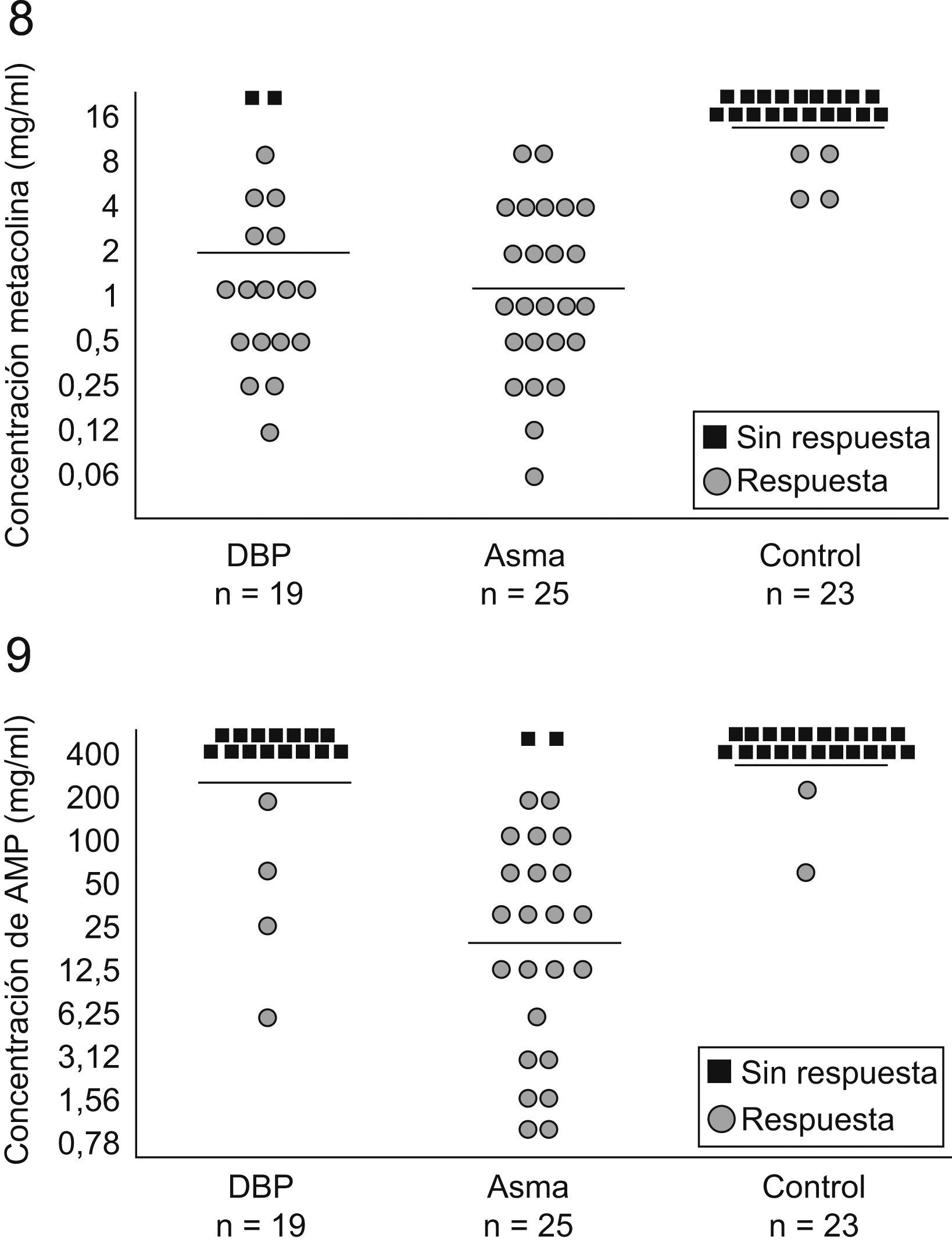
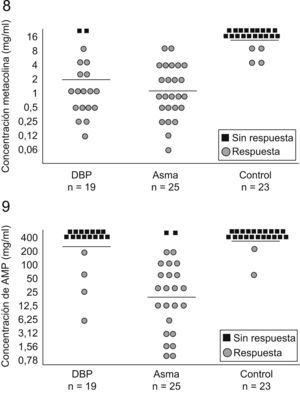
El distinto comportamiento fisiopatológico entre los niños con DBP y los niños con asma está siendo objeto de numerosos estudios. Recordemos que la adenosina 5′-monofosfato (AMP) provoca broncoconstricción y estimula o aumenta la liberación de mediadores desde los mastocitos, mientras que la metacolina o la histamina actúan directamente en el músculo liso bronquial para provocar esta broncoconstricción. La HRB a la metacolina está presente tanto en el asma como en otras enfermedades crónicas del pulmón, mientras que la HRB a la AMP está presente sobre todo en el asma con base atópica. En un estudio en el que se valoró la respuesta a la metacolina y a la AMP, se encontró respuesta positiva a la metacolina en el 89,5% de los pacientes con DBP, pero sólo tuvieron respuesta positiva a la AMP un 21,1% de ellos. Todos los pacientes con asma respondieron positivamente a la metacolina y la mayoría de ellos (92%) también respondieron a la AMP. La mayoría de los controles no respondió a ninguno de los 2 estímulos (figs. 8 y 9)78. Los autores concluyeron que la HRB a la metacolina es un hallazgo frecuente en preescolares con DBP, pero no suele estar acompañada de HRB a la AMP. Esto indica que la mayoría de los pacientes con DBP no tienen la misma respuesta inflamatoria de la vía aérea que los pacientes asmáticos. Por otra parte, 3 de los 4 pacientes que respondieron a la AMP eran atópicos, lo que apoya la hipótesis de que el status atópico es un factor determinante en la respuesta a la AMP79.
Respuesta bronquial a la metacolina y a la adenosina 5′-monofosfato en 3 grupos de niños78.
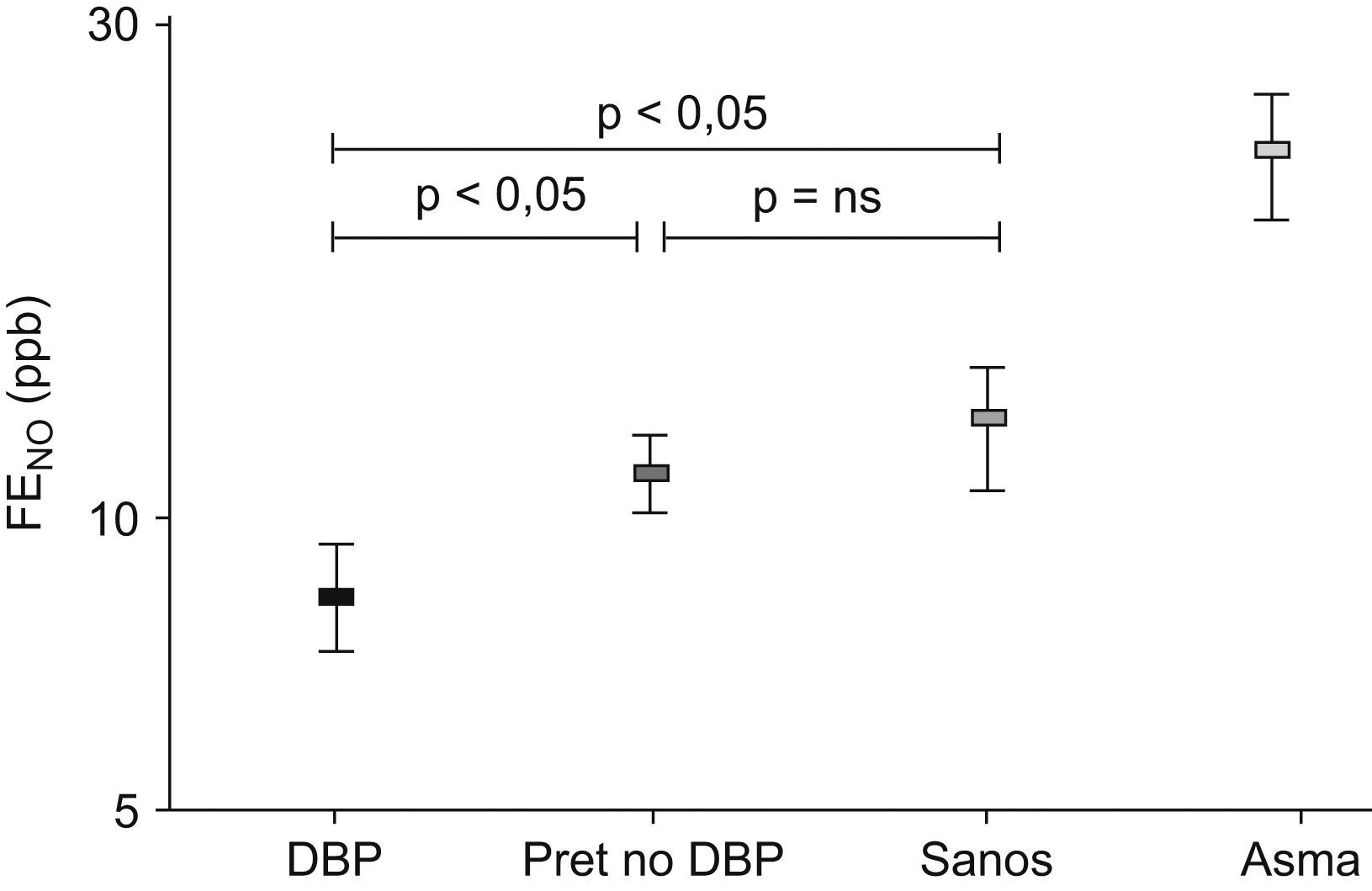
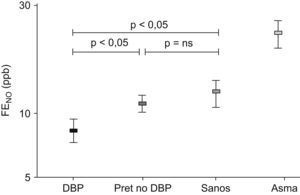
Estos resultados están en concordancia con los estudios sobre la fracción exhalada de óxido nítrico (FENO) realizados en niños con antecedentes de DBP. Como sabemos, el FENO es un marcador de inflamación eosinofílica de la vía aérea, habitualmente elevado en los pacientes asmáticos80. En 118 niños menores de 2 años estudiados en Holanda81 con distintas enfermedades respiratorias (sibilancias recurrentes, fibrosis quística y DBP), se midió el FENO y se comparó con el de 100 controles sanos; el FENO en las sibilancias recurrentes atópicas fue el más elevado. Las sibilancias no atópicas tuvieron cifras de FENO similares a los sanos y a los con DBP. Baraldi et al estudiaron a niños en edad escolar (edad media: 8,6 años) con antecedentes de DBP y los compararon con niños nacidos pretérmino sin DBP, niños con asma bronquial y niños sanos (fig. 10)82. En todos ellos estudiaron la función pulmonar e hicieron una medición de la FENO para valorar la inflamación de las vías aéreas. El grupo de niños con DBP mostró distintos grados de obstrucción de la vía aérea (FEV1: 77,8%) y no hubo repuesta a los agonistas β2 adrenérgicos en el 72% de los casos. Sus valores de FENO fueron significativamente (p<0,05) más bajos (7,7±1,1ppb) que los del grupo de niños normales nacidos a término (10±1,1ppb) y que los del grupo de niños pretérmino sin DBP (9,9±1,1ppb). Al compararlos con el grupo de niños asmáticos, cuyo grado de obstrucción bronquial era similar (FEV1: 80,2%), la diferencia fue aun mayor, ya que los niños asmáticos tuvieron cifras de FENO de 24,9±1,2ppb (p<0,001). Concluyeron que, a diferencia de los niños asmáticos, los supervivientes de DBP en edad escolar tienen limitación al flujo aéreo no asociado al incremento de la FENO. Las bajas cifras de FENO y la falta de reversibilidad tras los agonistas β2 adrenérgicos en muchos de estos niños indican que en los niños con DBP existe un mecanismo fisiopatológico distinto al del asma. Según estos autores, los valores bajos de FENO en los pacientes con DBP pueden tener una explicación basada en la “hipótesis vascular”, propuesta recientemente para explicar algunos hallazgos de la enfermedad83, según la cual el daño pulmonar precoz en estos niños condiciona un crecimiento vascular dismórfico con una reducción del lecho vascular. Como resultado, existirá menor liberación y difusión del óxido nítrico desde el endotelio hacia la luz de la vía aérea con menores niveles de FENO. Esta hipótesis explicaría también el porqué los pretérmino sin DBP no tienen el FENO tan reducido. Resultados semejantes se han encontrado en otros estudios84.
Valores de la fracción exhalada de óxido nítrico en niños pretérmino en edad escolar82.
Además, estudios realizados con tomografía axial computarizada han documentado diferencias morfológicas entre los pulmones de niños con DBP y niños con asma. Aunque el engrosamiento de las paredes y las áreas de menor densidad pueden verse en ambas enfermedades y un porcentaje elevado (>80%) de adultos jóvenes con antecedentes de DBP presentan signos de atrapamiento aéreo en la tomografía axial computarizada85,86; la fibrosis del parénquima y la distorsión de su estructura son característicos de la DBP y poco frecuentes en el asma87.
Las alteraciones de la función pulmonar y las características clínicas son muy similares, pero los datos disponibles en el momento actual indican que la DBP y el asma son 2 entidades clínicas distintas, si bien pueden coexistir88. Los bajos niveles de FENO en la edad escolar, la menor atopia en los exprematuros con sibilancias y los escasos efectos terapéuticos de los corticoides inhalados apoyan esta hipótesis.
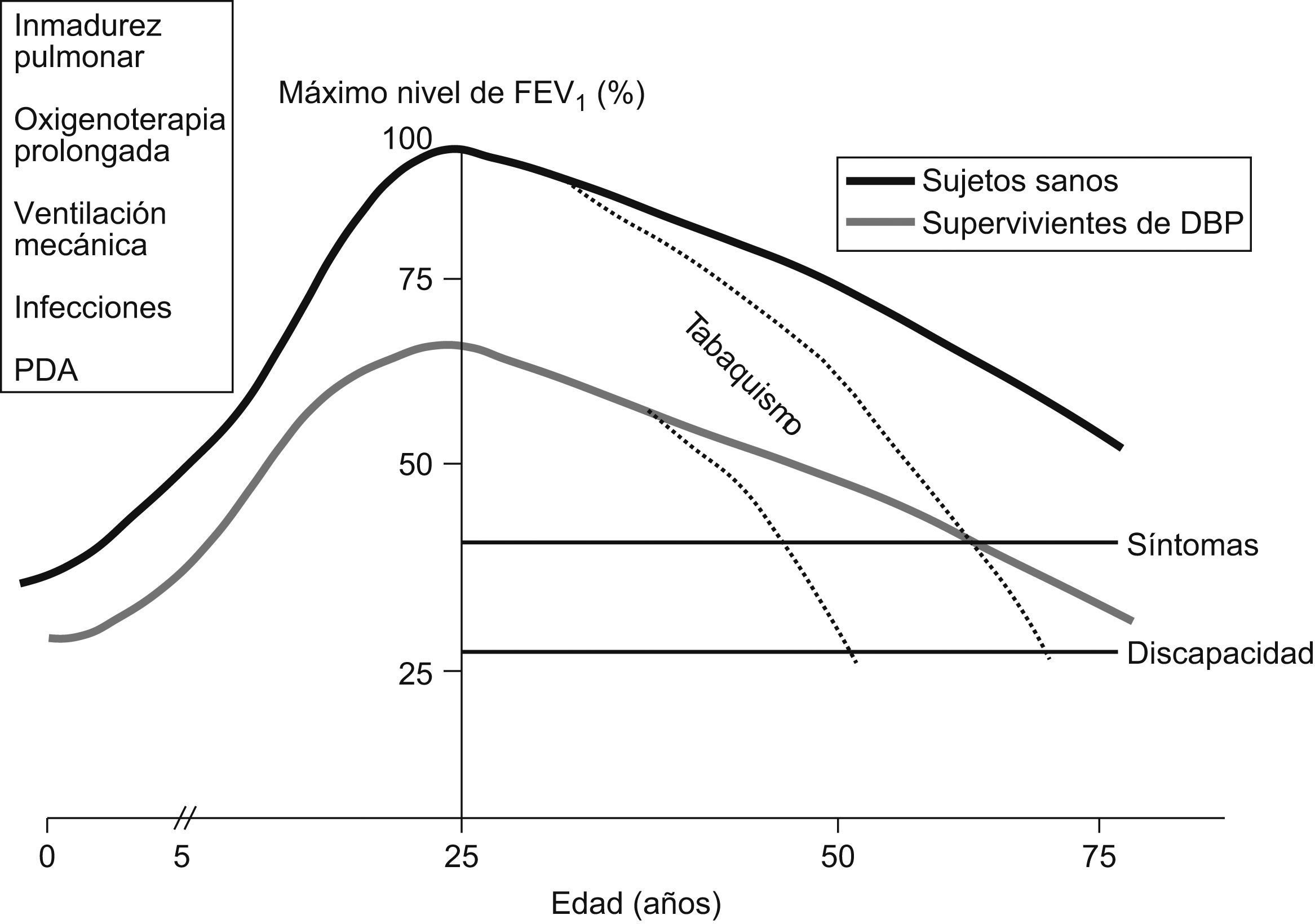
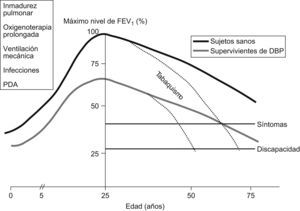
¿Qué ocurre en la edad adulta tardía?Aunque no existen estudios relevantes sobre las implicaciones que la prematuridad y la DBP puedan tener en la edad adulta tardía, se especula que la alteración de la función pulmonar que se observa en la infancia y la adolescencia puede tener consecuencias posteriores y facilitar enfermedades respiratorias obstructivas, como la EPOC5,8,32,89,90. Como sabemos, en sujetos normales, el FEV1 va aumentando progresivamente hasta alcanzar su valor máximo en la edad adulta joven, permanece estable durante varios años y luego comienza a disminuir lentamente (alrededor de 30ml al año) hasta la senectud, aunque nunca alcanza valores incapacitantes91. La situación es más compleja en sujetos fumadores, en los que el descenso de los valores del FEV1 puede ser más rápido (incluso 60ml/año), lo que puede desarrollar una enfermedad obstructiva grave. Si aplicamos este modelo a los supervivientes de DBP, en los que la función pulmonar es subóptima debido al daño pulmonar en el período perinatal y parten de un FEV1 inferior o igual al 80% del teórico, podemos concluir que pueden llegar a tener enfermedad pulmonar crónica en la edad adulta, y de manera más preocupante en el caso de fumadores (fig. 11). Se estima que la reducción en la función respiratoria de los fumadores que han sido prematuros es varias veces mayor que la de fumadores nacidos a término92.
Cambios en el flujo espiratorio en el primer segundo. Modelo teórico en supervivientes de displasia broncopulmonar y sujetos sanos91.
Concluimos que la DBP no puede considerarse una enfermedad exclusiva de la edad pediátrica, ya que los sujetos con esta enfermedad tienen síntomas respiratorios durante la infancia, la adolescencia e incluso en la edad adulta joven. Con frecuencia, persisten alteraciones de la función pulmonar, sobre todo las relacionadas con los flujos espiratorios. A pesar de las similitudes con el asma bronquial, comprobamos que el comportamiento fisiopatológico es distinto.
Aunque menos intensos, también se observan síntomas respiratorios y alteraciones de la función pulmonar en prematuros que no han tenido DBP.
Tras lo expuesto, consideramos de gran valor el seguimiento a largo plazo de los niños prematuros porque pueden constituir un sustrato importante para el desarrollo de la EPOC en edades tardías, sobre todo si se asocian otros factores, como el tabaquismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.