La obesidad es el trastorno nutricional más frecuente durante la infancia y adolescencia. El incremento de su prevalencia y de la intensidad del exceso ponderal han puesto de manifiesto las numerosas e importantes comorbilidades asociadas a la misma. La hiperinsulinemia y la resistencia a la insulina son el eje central del desarrollo posterior de estados de intolerancia a la glucosa, diabetes tipo 2 y/o síndrome metabólico. El depósito de grasa en el espacio visceral abdominal y en el espacio miocelular, y no la obesidad per se, es el principal factor independiente de riesgo para desarrollar resistencia a la insulina y el síndrome metabólico. Otros elementos del síndrome metabólico, como la dislipemia y la hipertensión pueden también estar ya presentes en los niños y adolescentes obesos y están estrechamente relacionados con el grado de adiposidad y con la presencia de resistencia a la insulina. En el transcurso de los últimos años se ha comprobado que la persistencia de la obesidad y de sus alteraciones metabólicas en la edad adulta incrementa de forma significativa el riesgo de presentar enfermedad cardiovascular degenerativa precoz y determina una menor esperanza de vida.
Obesity is the most frequent nutritional disorder in childhood and adolescence. The rise in its prevalence and severity has underlined the numerous and significant obesity-related metabolic disorders. Altered glucose metabolism, manifested as impaired glucose tolerance, appears early in severely obese children and adolescents. Obese young people with glucose intolerance are characterized by marked peripheral insulin resistance and relative beta-cell failure. Lipid deposition in muscle and the visceral compartment, and not only obesity per se, is related to increased peripheral insulin resistance, the triggering factor of the metabolic syndrome. Other elements of the metabolic syndrome, such as dyslipidaemia, and hypertension, are already present in obese youngsters and worsen with the degree of obesity. The long-term impact of obesity-related insulin resistance on cardiovascular morbidity in these patients is expected to emerge as these youngsters become young adults.
La obesidad en la edad pediátrica constituye uno de los problemas de salud pública más importantes de nuestra sociedad. No sólo porque su incidencia está aumentando de forma considerable, sino porque la obesidad del niño tiende a mantenerse en la adolescencia y la del adolescente en la vida adulta1–4. Datos recientes procedentes del Estudio Español de Crecimiento 2008 muestran que la tasa de sobrepeso en la población de niños, adolescentes y adultos jóvenes de 4 a 24 años se ha incrementado aproximadamente un 10% en los últimos 20 años; estimándose que en la actualidad el 20% de los niños y adolescentes jóvenes varones y el 15% en las niñas y adolescentes jóvenes mujeres presentan sobrepeso y que el 5% de esta población y en este rango de edad presentan obesidad de acuerdo con los criterios internacionales definidos por Cole en 20005–7.
La obesidad infanto-juvenil constituye un factor de riesgo para el desarrollo a corto término (infancia y adolescencia) y a largo término (vida adulta), de complicaciones ortopédicas, respiratorias, cardiovasculares, digestivas, dermatológicas, neurológicas, endocrinas, ciertas formas de cáncer y en general una menor esperanza de vida8,9. La obesidad infantil tiende a perpetuarse en la edad adulta produciendo alteraciones en el metabolismo de los hidratos de carbono y en el perfil de los lípidos plasmáticos, favoreciendo el desarrollo de hipertensión arterial y el desarrollo precoz de la aterogénesis10,11. La obesidad durante la adolescencia aumenta el riesgo de síndrome metabólico (SM) y la mortalidad cardiovascular en la vida adulta12–15.
Obesidad y resistencia a la insulinaLa mayor parte de las complicaciones metabólicas y cardiovasculares de la obesidad están estrechamente relacionadas con la presencia de hiperinsulinemia y de resistencia a la insulina16,17. Se estima que aproximadamente el 55% de la variabilidad de la sensibilidad a la insulina en los niños está determinada por el contenido de tejido adiposo tras ajustar por edad, sexo, raza y estadio puberal18,19. La resistencia a la insulina se caracteriza por la ausencia, en los tejidos periféricos diana, de una respuesta normal a la acción de dicha hormona. La insulinorresistencia tiene como mecanismo compensador la hiperproducción de insulina (hiperinsulinismo), estado que puede ser compatible con una glucemia normal. Sólo cuando la hiperinsulinemia compensadora resulte insuficiente para mantener la homeostasis, aparecerá intolerancia a la glucosa y posteriormente diabetes tipo 2. La resistencia a la insulina a nivel celular ocurre en múltiples tejidos y resulta en un incremento de la liberación de glucosa de origen hepático y una captación disminuida a nivel muscular y del tejido graso. El mecanismo fisiopatológico por el que la obesidad induce resistencia a la insulina no es bien conocido, aunque parece ser multifactorial. Se han propuesto diferentes mecanismos patogénicos. Desde una disminución efectiva del número de receptores de insulina a defectos del receptor de la insulina o en la señalización intracelular posreceptor, al incremento de los ácidos grasos circulantes que interfieren con la captación de glucosa a nivel periférico, a la disminución efectiva del número de mitocondrias y/o a su disfunción en el tejido muscular y, por último, al incremento del depósito de grasa visceral, siendo éste el principal factor independiente de riesgo en el desarrollo de estados de resistencia a la insulina tanto en niños como adultos20.
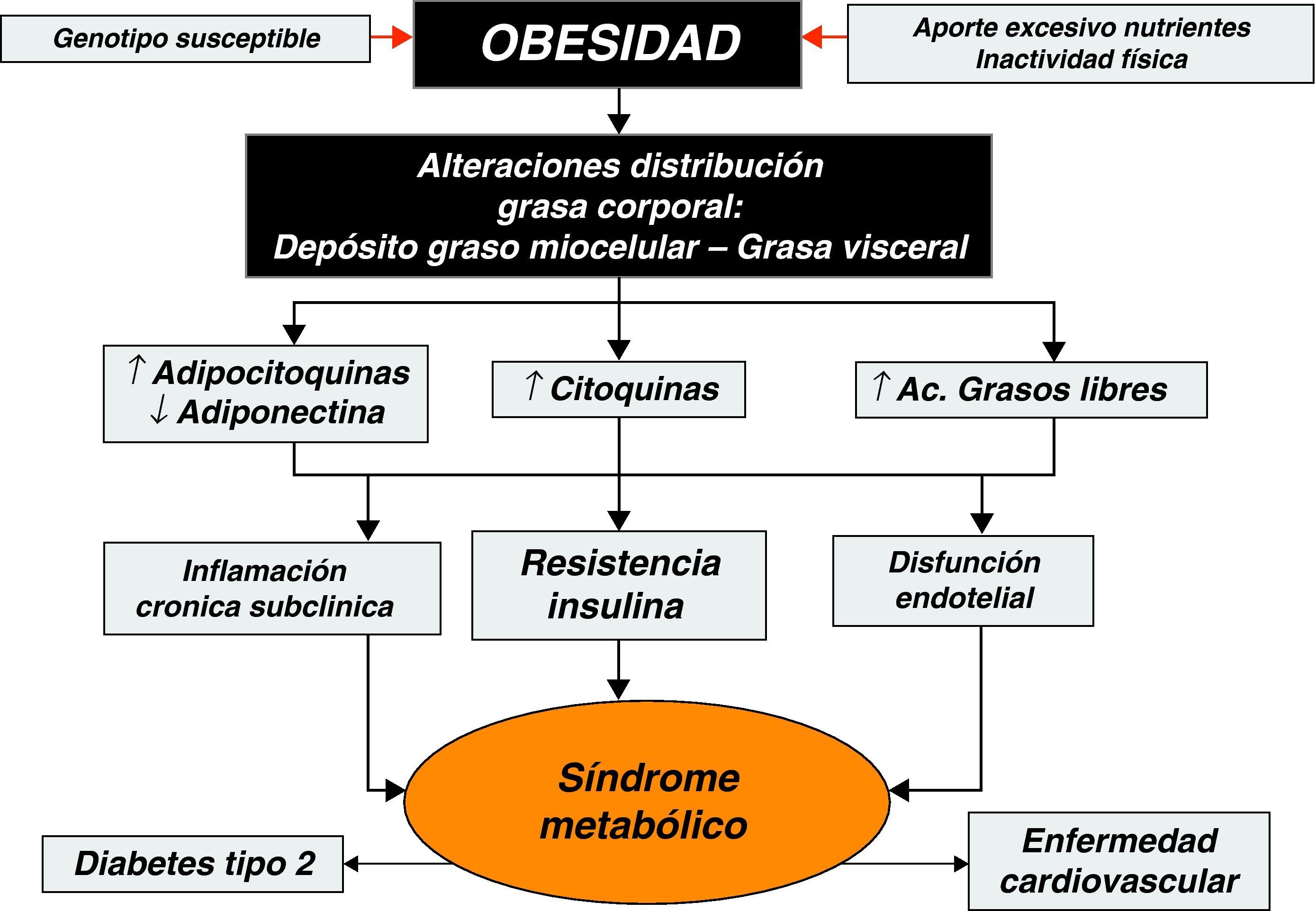
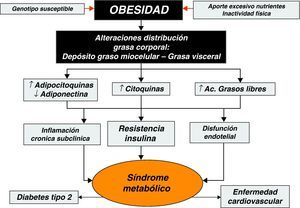
En el transcurso de los últimos años se ha puesto de relieve la capacidad del tejido adiposo y en especial el depositado a nivel visceral, para producir una gran variedad de moléculas multifuncionales, denominadas colectivamente adipocitoquinas, que ejercen un papel muy destacado en la regulación del metabolismo y la homeostasis energética del organismo, y parecen ser piezas claves en el desarrollo de los estados de resistencia a la insulina por su capacidad para modular los efectos de la insulina a nivel del receptor o posreceptor21,22 (fig. 1).
La adiponectina es una hormona proteica de síntesis prácticamente adipocitaria con importantes efectos antidiabéticos y antiaterogénicos en humanos y mamíferos. Sus niveles circulantes están reducidos en la obesidad, estados de resistencia a la insulina y diabetes tipo 2, así como en la enfermedad cardiovascular y la hipertensión23. Su acción antidiabética y de mejora de sensibilidad a la insulina se explica en gran parte por sus efectos en el metabolismo hepático y muscular. Inhibe la gluconeogénesis hepática, aumenta la captación y la utilización de la glucosa por el músculo esquelético y favorece la reducción del depósito de triglicéridos en hígado y músculo, ya que estimula la oxidación de ácidos grasos y suprime la lipogénesis. En niños y adolescentes, la adiponectina es un excelente factor predictivo de la sensibilidad a la insulina, con independencia del grado de adiposidad24, de tal forma que la reducción de los niveles de esta citocina se ha implicado como mecanismo patogénico de la resistencia a la insulina y del SM25.
El tejido adiposo es también fuente de otras citocinas con importante actividad proinflamatoria, como el factor de necrosis tumoral alfa, la interleucina-6, amiloide sérico A, resistina e inhibidor del activador del plasminógeno, entre otras. Estas moléculas participan muy activamente en la modulación de la inflamación crónica de baja intensidad que acompaña a la obesidad y también parecen intervenir activamente en el desarrollo de la resistencia a la insulina26-28. También se ha observado la existencia de una relación muy estrecha entre el desarrollo de resistencia a la insulina y las concentraciones de leptina29 y de la proteína transportadora de retinol en niños y adolescentes obesos30,31.
Asimismo, recientemente se ha podido comprobar que las alteraciones en el patrón de la distribución corporal de la grasa (subcutánea y visceral) o su depósito en localizaciones no habituales, como en el hígado y en el músculo, son factores determinantes en el desarrollo de la resistencia a la insulina en niños y adolescentes32,33. La regulación y la función metabólica del tejido adiposo visceral son muy distintas del tejido adiposo subcutáneo y se caracterizan por su mayor sensibilidad a estímulos betaadrenérgicos34, lo que determina una alta actividad lipolítica con incremento de la liberación de ácidos grasos y glicerol, que son transportados directamente por el eje portal al hígado13. El mecanismo en virtud del cual el tejido adiposo visceral causa resistencia a la insulina se atribuye a los ácidos grasos libres que interfieren con la actividad de la insulina en sus tejidos diana. Estudios recientes, mediante resonancia magnética, han demostrado que los ácidos grasos libres inhiben la cascada de acción de la insulina y bloquean el efecto de la insulina sobre la translocación de los transportadores de glucosa GLUT-4 desde sus lugares de almacenamiento intracelular hacia la membrana plasmática, con lo cual disminuye el transporte efectivo de glucosa mediado por la insulina hacia el interior de la célula35. Además, el incremento del depósito de grasa a nivel visceral también se ha relacionado con un perfil metabólico más aterogénico en la infancia36 y con la disminución efectiva de las concentraciones de adiponectina, incluso cuando se comparan entre individuos con un grado de adiposidad similar37. La sobreoferta de ácidos grasos libres que traspasan el filtro hepático favorecen su distribución y depósito en otros tejidos, pero muy especialmente a nivel del espacio miocelular del músculo esquelético, donde se ha comprobado que su acumulación está estrechamente relacionada con la disminución de la sensibilidad periférica a la insulina38–40. El depósito de material lipídico en este espacio está ya presente en las fases iniciales del desarrollo de la obesidad infantil41, aunque debe subrayarse que ni los niños y adolescentes con mayor grado de adiposidad ni aquellos que muestran una menor sensibilidad a la acción de la insulina presentan de forma invariable un mayor contenido de grasa a este nivel42. Se ha podido comprobar que los hijos de los padres con diabetes tipo 2 tienen un menor contenido de mitocondrias en el tejido muscular esquelético y que ésta podría ser la causa subyacente del incremento del depósito de grasa observado en estos sujetos43,44. De esta forma, se ha especulado con la posibilidad de que, al menos en parte, el depósito de lípidos en este espacio puede estar determinado genéticamente, y que los sujetos obesos con esta predisposición alcancen un mayor acúmulo de grasa a nivel muscular y que desarrollen, por tanto, estados de resistencia a la insulina de mayor severidad que los sujetos obesos sin predisposición genética que presentan un comportamiento metabólico mucho más benigno.
En los niños obesos, la nutrición puede ser un factor adicional favorecedor del desarrollo de estados de resistencia a la insulina. Diferentes estudios de base experimental en modelos animales y clínicos en humanos ponen de relieve que tanto las dietas hipercalóricas como aquellas con un elevado contenido de grasa y carbohidratos y con un bajo aporte de fibra favorecen el desarrollo de resistencia a la insulina45.
La valoración del contenido graso en el espacio intramiocelular no es fácil de determinar en la práctica clínica; sin embargo, una estimación indirecta del contenido de la grasa visceral puede obtenerse con la medida del perímetro de la cintura, que se ha demostrado de ser gran utilidad para identificar los niños y adolescentes obesos con resistencia a la insulina y riesgo de presentar SM, por lo que se aconseja su medida rutinaria en todos los niños y adolescentes obesos46.
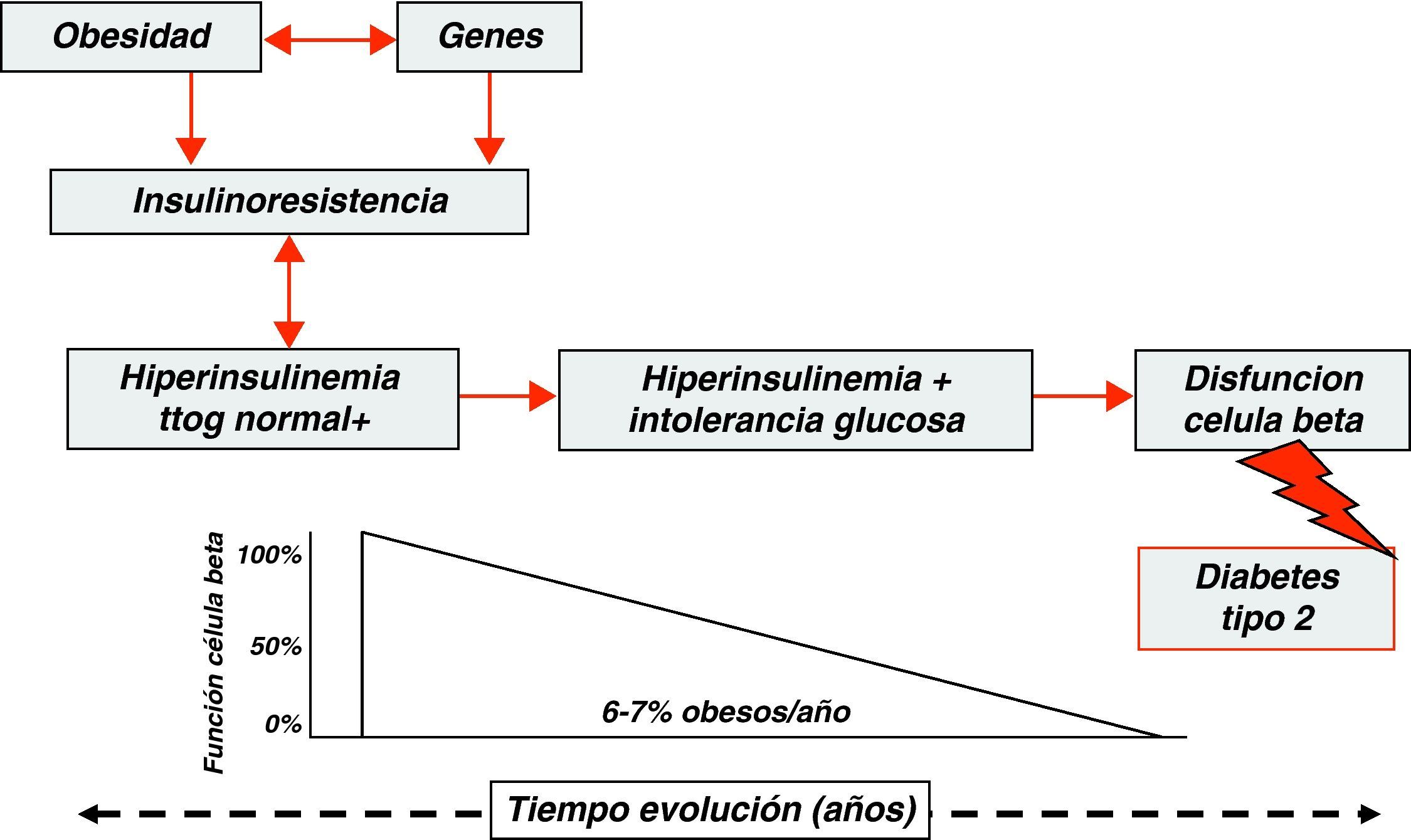
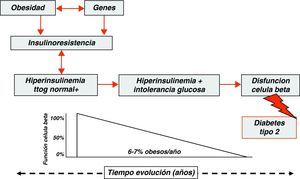
Trastornos del metabolismo de la glucosa en los niños obesosDurante los últimos años el aumento observado en la prevalencia de obesidad en las sociedades industrializadas se ha visto acompañado de un incremento paralelo en la incidencia de diabetes tipo 2, tanto en poblaciones adultas como pediátricas47–49. En poblaciones adultas obesas se ha comprobado que la diabetes tipo 2 se desarrolla en la mayoría de los sujetos después de un tiempo variable de evolución. Durante este periodo se pueden poner de manifiesto en estos pacientes estados de intolerancia a la glucosa que pueden representar un estadio intermediario de la historia natural de la diabetes tipo 2, estimándose que anualmente entre el 6 y el 7% de los pacientes con estados de intolerancia a la glucosa evolucionan a diabetes tipo 250,51,54 (fig. 2).
En poblaciones pediátricas obesas la existencia de estados de resistencia a la insulina pueden ser el punto de partida para el desarrollo posterior de diabetes tipo 2 y/o SM52,53, habiéndose definido recientemente la prediabetes tipo 2 en el adolescente obeso27. En un estudio diseñado con objeto de conocer la causa subyacente de la intolerancia a la glucosa en los niños y adolescentes obesos, se puso de manifiesto que los sujetos con intolerancia a la glucosa eran significativamente más insulinorresistentes que los individuos con tolerancia normal a la glucosa, a pesar de que el grado de adiposidad era similar en ambos grupos. Las diferencias observadas en la sensibilidad a la insulina en estas poblaciones pudieron atribuirse finalmente a las diferencias observadas en el patrón de distribución del contenido graso corporal. Los adolescentes con intolerancia a la glucosa mostraron mayor depósito de grasa intramiocelular en comparación con los adolescentes obesos sin intolerancia a la glucosa, lo que de nuevo resalta la importancia que tiene el patrón de la distribución de la grasa corporal como mecanismo patogénico de desarrollo de la resistencia a la insulina y de las alteraciones del metabolismo de los hidratos de carbono en los niños y adolescentes obesos33.
Recientemente, nuestro grupo ha presentado los resultados de un estudio prospectivo que tuvo como objeto determinar la prevalencia de la intolerancia a la glucosa y de la diabetes tipo 2 en una cohorte de 145 niños y adolescentes obesos de ambos sexos y de edades comprendidas entre los 4 y 18 años54. Participaron 60 niños y adolescentes con un índice de masa corporal (IMC) de 29,5±4,9 y valor Z-score de IMC 4,4±1,7 y 85 niñas y adolescentes con un IMC de 28,8±4,6, y valor Z-score de IMC 3,8±1,4, y con la siguiente distribución puberal: 57 pacientes prepuberales, 40 pacientes puberales y 48 pacientes en estadio V de Tanner. Todos los pacientes incluidos en el estudio eran de raza caucásica blanca, no pertenecían a minorías raciales, no estaban afectados de enfermedades crónicas y no tomaban fármacos de forma habitual. La prevalencia de la intolerancia a la glucosa para todo el conjunto de la muestra de niños y adolescentes obesos fue del 19,2%. Sin embargo, la prevalencia de intolerancia a la glucosa varió según el IMC (desde un 8,7% en el grupo con valores Z-score de IMC comprendidos entre +2 y +3, a un 21,5% en el grupo con valores Z-score de IMC entre +3 y +4, y a un 25,0% en aquellos que tenían valores superiores a +4), y también con relación al estadio puberal (el 7,5% de los sujetos en estadio I de Tanner, el 39% durante la pubertad y el 36% en la edad adulta). No obstante, no se observaron diferencias estadísticamente significativas en el valor medio del Z-score del IMC en los diferentes estadios puberales. Ninguno de los participantes cumplió criterios de diabetes tipo 2.
Este porcentaje es ligeramente inferior al comunicado en un reciente estudio efectuado en Estados Unidos en una población multirracial (del 21 al 25% de los sujetos con intolerancia a la glucosa en función del grupo étnico de procedencia y un 4% de diabetes tipo 2)55 y es superior al observado en una población de niños y adolescentes obesos de nacionalidad italiana, que arroja una prevalencia de intolerancia a la glucosa del 4,5% y de diabetes tipo 2 del 0,14%, aunque el IMC de estos pacientes es inferior al de nuestra población56.
Nuestro estudio pone de relieve que la proporción de niños y adolescentes con intolerancia a la glucosa varía con el valor de su Z-score del IMC y que en los valores comprendidos entre +2 y +3 el porcentaje es pequeño (8,7%), para triplicarse en aquellos que tienen valores superiores a +3 y a +4, y con el desarrollo de la pubertad, pasando de ser del 7,5% en los sujetos prepuberales al 39% en los sujetos puberales y del 36% en los que han alcanzado la edad adulta, a pesar de que los valores del Z-score del IMC no mostraron diferencias estadísticamente significativas con relación al estadio puberal. Debido a que desconocemos el tiempo de evolución de la obesidad en estas poblaciones no parece razonable atribuir exclusivamente este incremento de la prevalencia de la intolerancia a la glucosa a la edad de los sujetos, aunque es conocido que durante el desarrollo de la pubertad se incrementa de forma fisiológica la resistencia a la acción de la insulina en los tejidos periféricos57.
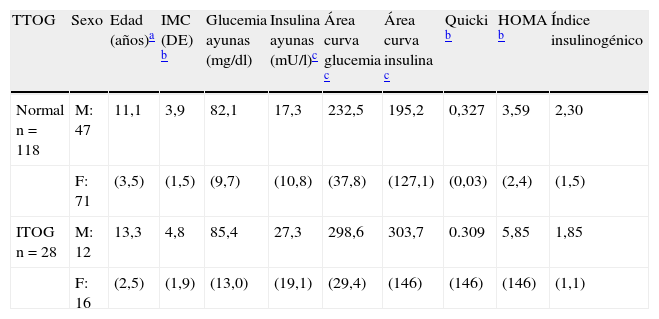
En la tabla 1 se muestran los valores de la media±DE para la edad, Z-score del IMC, glucemia basal, insulina basal, área bajo la curva de glucosa, área bajo la curva de insulina, índice QUICKI, índice HOMA e índice insulinogénico, en función del resultado del test de tolerancia oral a la glucosa (TTOG). Nuestros datos muestran que los niños y adolescentes con intolerancia a la glucosa presentan valores más elevados y estadísticamente significativos para los siguientes parámetros: Z-score del IMC, insulinemia basal, áreas baja la curva para la glucosa e insulina, e índice HOMA, y que los valores del índice QUICKI están significativamente disminuidos en los niños y adolescentes con intolerancia a la glucosa. Estos resultados sugieren que la presencia de intolerancia a la glucosa está estrechamente relacionada con el grado de obesidad y la resistencia a la insulina. Estos datos son concordantes con los trabajos que mediante clamp euglicémico-hiperinsulinémico e hiperglucémico han demostrado que los niños y adolescentes obesos con intolerancia a la glucosa presentan insulinorresistencia y alteraciones en el metabolismo no oxidativo de la glucosa de forma similar a como se observa en los pacientes obesos adultos58,59, y hacen sospechar que la progresión hacia los estados de intolerancia a la glucosa en los niños y adolescentes obesos se debe a una menor sensibilidad a la acción periférica de la insulina que, a su vez, desencadena un estado de hiperinsulinismo compensatorio suficiente para mantener el estado euglucémico durante algún tiempo. Superada esta capacidad secretora de las células beta pancreáticas, la diabetes mellitus tipo 2 se manifiesta clínicamente, pudiendo ser éste uno de los factores o mecanismos involucrados en la génesis de la intolerancia a la glucosa de los niños y adolescentes obesos60.
Distribución de los valores de la edad, z-score IMC, glucemia basal, insulina basal, área bajo la curva de glucosa, área bajo la curva de insulina, índice QUICKI, índice HOMA e índice insulinogénico de los pacientes obesos con relación al resultado del test de tolerancia oral a la glucosa (TTOG) y su significación estadística entre la población de sujetos con TTOG normal y con intolerancia a la glucosa (ITOG)
| TTOG | Sexo | Edad (años)a | IMC (DE) b | Glucemia ayunas (mg/dl) | Insulina ayunas (mU/l)c | Área curva glucemia c | Área curva insulina c | Quicki b | HOMA b | Índice insulinogénico |
| Normal n=118 | M: 47 | 11,1 | 3,9 | 82,1 | 17,3 | 232,5 | 195,2 | 0,327 | 3,59 | 2,30 |
| F: 71 | (3,5) | (1,5) | (9,7) | (10,8) | (37,8) | (127,1) | (0,03) | (2,4) | (1,5) | |
| ITOG n=28 | M: 12 | 13,3 | 4,8 | 85,4 | 27,3 | 298,6 | 303,7 | 0.309 | 5,85 | 1,85 |
| F: 16 | (2,5) | (1,9) | (13,0) | (19,1) | (29,4) | (146) | (146) | (146) | (1,1) |
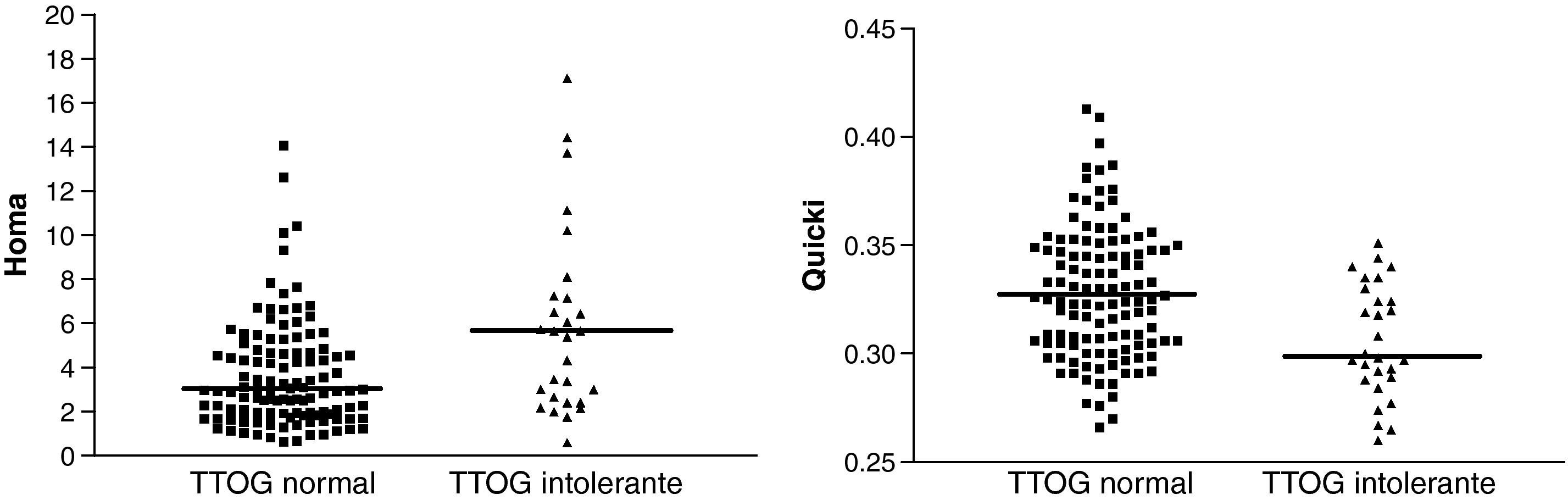
Otro de los objetivos de nuestro estudio fue analizar si las determinaciones basales de insulina y los valores de los índices HOMA y QUICKI eran capaces de discriminar la existencia de intolerancia a la glucosa. Aunque la media de los valores de la insulina en ayunas, y de los índices HOMA y QUICKI fueron estadística y significativamente diferentes en las poblaciones analizadas, tan solo permitieron discriminar la existencia de intolerancia a la glucosa en un pequeño número de sujetos con valores muy extremos (fig. 3).
Por el momento, se desconoce si los adolescentes obesos sufren un periodo prolongado de hiperglucemia asintomática antes de presentar la diabetes tipo 2 y si el grado de riesgo es equivalente al de los adultos, aunque recientemente se ha podido constatar que la transición desde los estados de tolerancia normal a la glucosa a la intolerancia a la glucosa y desde ésta a la diabetes tipo 2 en adolescentes obesos está íntimamente relacionada con el aumento significativo del peso corporal en el tiempo; siendo reversible siempre que se produzca un incremento de la actividad física y la disminución efectiva del peso del paciente61. Los parámetros con mejor capacidad predictiva para estimar la progresión de la intolerancia a la glucosa y a la diabetes tipo 2 fueron la persistencia de la resistencia a la insulina que estuvo directamente relacionada con el grado de adiposidad y la disminución de la primera fase de secreción de la insulina62. De todos modos, son precisos un mayor número de estudios longitudinales para determinar la secuencia de los sucesos fisiológicos implicados en la transición de normalidad a la intolerancia de glucosa, y de ésta a la diabetes tipo 2. Estos datos sugieren que todas aquellas medidas encaminadas a prevenir la progresión o la conversión de la prediabetes a la diabetes 2 deben tener como objetivo una mejoría de la función de la célula beta pancreática63.
Las determinaciones basales de glucemia, insulinemia y los índices HOMA y QUICKI no nos han permitido discriminar adecuadamente todos los niños y adolescentes obesos con intolerancia a la glucosa. Sin embargo, los índices de insulinorresistencia fueron los mejores predictores de las concentraciones plasmáticas de glucemia a las 2h del TTOG. Estos resultados nos llevan a seguir recomendando la realización del TTOG en el diagnóstico y el seguimiento de las poblaciones obesas mientras no se disponga de otros parámetros bioquímicos más específicos y con mejor capacidad para discriminar los estados de intolerancia a la glucosa.
Obesidad y síndrome metabólico en niños y adolescentesEl SM ha sido definido como la asociación de varios factores de riesgo precursores de enfermedad cardiovascular arteriosclerótica y de diabetes tipo 2 en el adulto. Ya en 1988, Reaven observó que algunos factores de riesgo, como la hiperinsulinemia/insulinorresistencia, la alteración de la tolerancia a la glucosa/diabetes tipo 2, la hipertensión arterial (HTA) y la dislipemia, solían aparecer frecuentemente agrupados. Denominó a esta asociación síndrome X y la reconoció como un factor de riesgo para presentar enfermedades cardiovasculares. Posteriormente, postuló que la insulinorresistencia desempeñaba un papel primordial en su fisiopatología y de ahí que también comenzara a denominársele como síndrome de insulinoresistencia64,65. La obesidad no fue incluida originalmente en la descripción original de Reaven, pero hoy en día está ampliamente documentado que la obesidad desempeña un papel central en la génesis del SM.
Aunque la existencia del SM puede demostrarse en la edad pediátrica; no existen unos criterios claramente definidos para su diagnóstico. Dado que cada uno de los factores involucrados tiene la tendencia de mantenerse a lo largo de la infancia y adolescencia hasta llegar al periodo adulto, se ha propuesto extrapolar criterios de adultos a los niños, ajustando los correspondientes valores pediátricos para edad y sexo. Muchos grupos de expertos, incluida la Organización Mundial de la Salud (OMS), el National Cholesterol Education Program (Adult Treatment Panel III), la Federación Internacional de Diabetes (IDF) y la Asociación Americana de Cardiología, han propuesto diferentes criterios diagnósticos para definir el SM en la edad pediátrica. Cook et al66, en un intento de unificar criterios, propuso una definición pediátrica del SM, modificando los criterios establecidos por la ATP-III. Esta ausencia de uniformidad de criterios para definir el SM en la infancia y la adolescencia justifica la amplia variabilidad comunicada en la prevalencia de SM en la edad pediátrica que puede oscilar entre el 3 y el 14% en función de la definición utilizada. No obstante, se ha comprobado que el 80% de los niños y adolescentes con SM son obesos y que la prevalencia de SM en poblaciones pediátricas afectadas de sobrepeso es del 6% y que puede variar entre el 20 y el 40% para las que presentan obesidad, estando esta prevalencia directamente relacionada con el grado de obesidad.
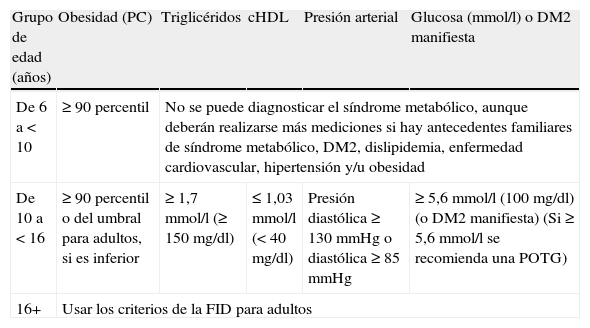
Como comentamos en el apartado anterior, en la actualidad está bien establecido que la asociación de la obesidad con el SM y el riesgo cardiovascular no depende exclusivamente del grado de obesidad, sino que se encuentra muy estrechamente relacionado con el patrón corporal de distribución grasa y con el contenido de grasa abdominal (adiposidad central). Por este motivo, recientemente la Asociación Americana de Cardiología y la Federación Internacional de Diabetes recomiendan estimar indirectamente su contenido mediante la medición del perímetro de la cintura en aquellos pacientes pediátricos y adolescentes con riesgo de insulinorresistencia e incluirla como criterio imprescindible para diagnosticar el SM en la edad pediátrica, ya que el IMC es un indicador poco sensible para evaluar la distribución grasa y que la sensibilidad a la insulina en los niños y adolescentes obesos y con un IMC similar se encuentra significativamente más reducida en aquellos que tienen un mayor contenido de grasa visceral (tabla 2)67. De todos modos está por determinar si estos criterios diagnósticos son o no adecuados para identificar los niños y adolescentes con SM cuando sean adultos.
Definición de la Federación Internacional de Diabetes del grupo de riesgo y el síndrome metabólico en niños y adolescentes
| Grupo de edad (años) | Obesidad (PC) | Triglicéridos | cHDL | Presión arterial | Glucosa (mmol/l) o DM2 manifiesta |
| De 6 a < 10 | ≥ 90 percentil | No se puede diagnosticar el síndrome metabólico, aunque deberán realizarse más mediciones si hay antecedentes familiares de síndrome metabólico, DM2, dislipidemia, enfermedad cardiovascular, hipertensión y/u obesidad | |||
| De 10 a < 16 | ≥ 90 percentil o del umbral para adultos, si es inferior | ≥ 1,7 mmol/l (≥ 150 mg/dl) | ≤ 1,03 mmol/l (< 40 mg/dl) | Presión diastólica ≥ 130mmHg o diastólica ≥ 85 mmHg | ≥ 5,6 mmol/l (100 mg/dl) (o DM2 manifiesta) (Si ≥ 5,6 mmol/l se recomienda una POTG) |
| 16+ | Usar los criterios de la FID para adultos | ||||
PC: perímetro de cintura; cHDL: colesterol unido a lipoproteínas de alta densidad; DM2: diabetes tipo 2; POTG: prueba oral de tolerancia a la glucosa.
Haciendo uso de esta nueva definición de SM, hemos estudiado su prevalencia en una población de 346 niños y adolescentes obesos de nuestro medio (180 varones), de 6 a 20 años (edad media de 11,7±2,9 años), todos de raza caucásica y con la siguiente distribución de IMC: IMC entre +2 y +3 DS: 36%, IMC entre +3 y + 4 DS: 32% e IMC > 4 DS: 32%68. Se han utilizado los criterios de IDF 2007 para la clasificación de SM: presencia de obesidad abdominal (perímetro cintura > P90 para la edad) y dos de los siguientes criterios: glucosa ayunas>100mg/dl, triglicéridos>150mg/dl, colesterol unido a lipoproteínas de alta densidad (cHDL) < 40mg/dl, PA sistólica>130mmHg o PA diastólica>85mmHg. Para mayores de 16 años se modifica el perímetro cintura para las mujeres (> 85cm) y para los varones (> 95cm) y el valor de cHDL en mujeres (< 50mg/dl). La IDF aunque recomienda no diagnosticar de SM a los niños menores de 10 años de edad, insta a mantener un especial seguimiento y control en estos pacientes.
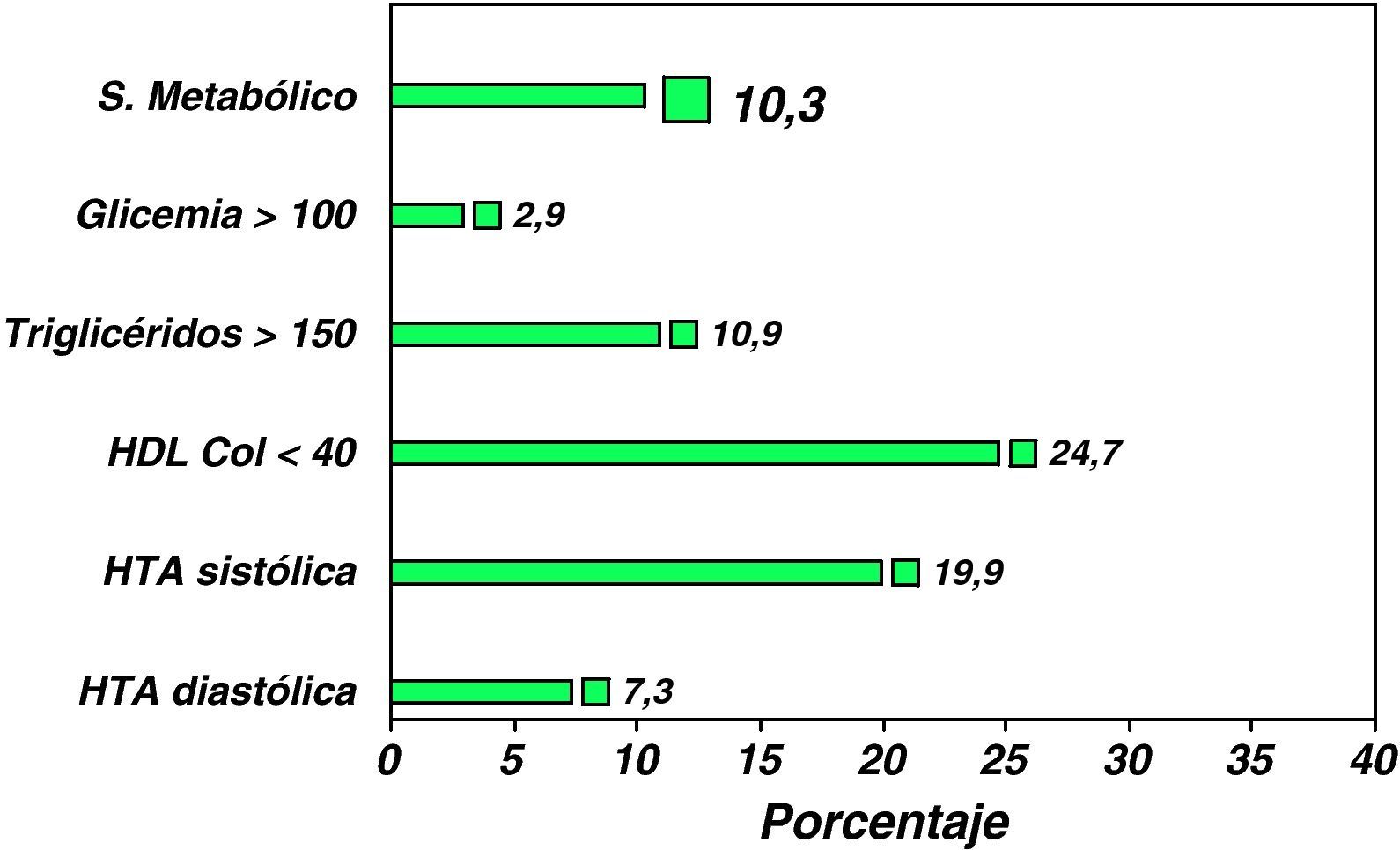
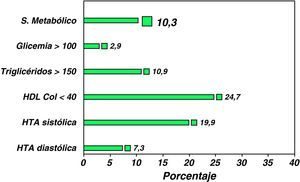
La prevalencia global de SM en esta cohorte ha sido del 10,7%, habiéndose observado una incidencia más elevada de SM en los pacientes obesos mayores de 16 años y de sexo masculino. La prevalencia de los diferentes componentes del SM ha sido la siguiente: HTA sistólica 19,9%, HTA diastólica: 7,3%, hipertrigliceridemia: 10,9%, concentraciones plasmáticas de cHDL inferiores a 40mg: 24,7% y de glucosa superior a 100mg/dl de 2,9% (fig. 4). Se han hallado diferencias estadísticamente significativas en la prevalencia de SM comparando grupos estratificados según el IMC z-score: IMC entre +2 y +3 DS: 5,5%, IMC entre +3 y +4 DS: 8,2% e IMC>4 DS: 19% (p=0,003), y por grupos de edad: niños menores de 10 años 3,5%, de 10 a 16 años 11,1% y mayores de 16 años 21,7% (p=0,01) y con relación al perímetro de la cintura. En resumen, los resultados de este estudio ponen de relieve que el SM está presente en un importante porcentaje de niños y adolescentes obesos. El grado de obesidad y la edad influyen en el incremento de su prevalencia.
En definitiva, el estudio sistemático de la presencia de complicaciones metabólicas (estados de resistencia a la insulina y/o SM) debe efectuarse de forma rutinaria en los niños y adolescentes obesos con objeto de identificar aquellos sujetos con mayor susceptibilidad y riesgo para presentar en etapas relativamente tempranas de la vida adulta diabetes tipo 2 y enfermedad cardiovascular precoz11,15. La identificación de estos trastornos metabólicos en los niños y adolescentes obesos debe promover la adopción, en primera instancia, de medidas enérgicas dirigidas fundamentalmente hacia la modificación de sus hábitos nutricionales y estilos de vida69.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.