Determinar si los niveles plasmáticos de región media del péptido natriurético proauricular (RM-proPNA), copeptina y procalcitonina (PCT) se asocian con aumento del riesgo de mortalidad.
MétodosEstudio prospectivo observacional que incluyó a 254 niños críticamente enfermos. Se compararon los niveles de RM-proPNA, copeptina y PCT entre niños con alto (grupo A; n=33) y bajo (grupo B; n=221) riesgo de mortalidad y entre pacientes con un número de órganos en fallo mayor de 1 (grupo 1; n=71) y menor de 2 (grupo 2; n=183).
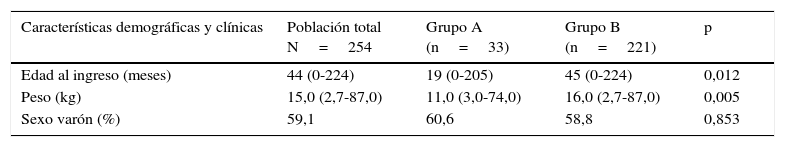
ResultadosLas medianas (rangos) de RM-proPNA, copeptina y PCT en grupo A vs. grupo B fueron, respectivamente: 209,4 (30,5-1.415,8) vs. 75,0 (14,6-867,2) pmol/l (p<0,001); 104,4 (7,4-460,9) vs. 26,6 (0,00-613,1) pmol/l (p<0,001) y 7,8 (0,3-552,0) vs. 0,3 (0,02-107,0) ng/ml (p<0,001). El área bajo la curva (AUC) para diferenciar grupo A y B fue (intervalo de confianza del 95%): 0,764 (0,674-0,854) para RM-proPNA; 0,735 (0,642-0,827) para copeptina y 0,842 (0,744-0,941) para PCT, sin diferencias significativas. Las AUC para diferenciar los grupos 1 y 2 fueron: 0,837 (0,784-0,891) para RM-proPNA, 0,735 (0,666-0,804) para copeptina y 0,804 (0,715-0,892) para PCT, con diferencias significativas entre RM-proPNA y copeptina, p=0,01.
ConclusionesLos niveles elevados de RM-proPNA, copeptina y PCT se asocian con aumento de las puntuaciones de riesgo de mortalidad. RM-proPNA mostró mayor asociación que la copeptina con el número de órganos en fallo.
To determine whether high levels of mid-regional pro-atrial natriuretic peptide (MR-proANP), copeptin, and procalcitonin (PCT) plasma concentrations are associated with increased mortality risk.
MethodsProspective observational study including 254 critically ill children. MR-proANP, copeptin and PCT were compared between children with high (Group A; n=33) and low (Group B; n=221) mortality risk, and between patients with failure of more than 1 organ (Group 1; n=71) and less than 2 (Group 2; n=183).
ResultsMedian (range) of MR-proANP, copeptin, and PCT levels in group A vs B were, respectively: 209.4 (30.5–1415.8) vs. 75.0 (14.6–867.2) pmol/L (P<.001); 104.4 (7.4–460.9) vs. 26.6 (0.00–613.1) pmol/L (P<.001), and 7.8 (0.3–552.0) vs. 0.3 (0.02–107.0) ng/mL (P<.001). The area under the curve (AUC) for the differentiation of group A and B was 0.764 (95% CI: 0.674-0.854) for MR-proANP; 0.735 (0.642-0.827) for copeptin, and 0.842 (0.744-0.941) for PCT, with no statistical differences. The AUCs for the differentiation of group 1 and 2 were: 0.837 (0.784-0.891) for MR-proANP, 0.735 (0.666-0.804) for copeptin, and 0.804 (0.715-0.892) for PCT, with statistical differences between MR-proANP and copeptin, P=.01.
ConclusionsHigh levels of MR-proANP, copeptin and PCT were associated with increased mortality risk scores. MR-proANP showed a higher association than copeptin with number of organs in failure.
La evaluación del pronóstico de un niño críticamente enfermo en las primeras 12 h de ingreso en la Unidad de Cuidados Intensivos Pediátricos (UCIP) sigue constituyendo un desafío clínico. Las herramientas más usadas actualmente para calcular el riesgo de mortalidad son escalas que se basan en signos clínicos y análisis de rutina. Dependiendo de las alteraciones existentes en los diferentes apartados de la escala se obtiene una puntuación que se correlaciona con la mortalidad de los pacientes. Las más utilizadas son el Riesgo pediátrico de mortalidad en su tercera versión (Pediatric risk of mortality III; PRISM III) y el Índice pediátrico de mortalidad en su segunda versión (Pediatric index mortality 2 [PIM 2])1-5.
En los últimos años se ha comprobado que existen marcadores bioquímicos que pueden elevar sus niveles plasmáticos en relación con la gravedad de los pacientes. La procalcitonina (PCT) surgió como marcador de sepsis6 y, posteriormente, como ayuda en la clasificación de la gravedad y pronóstico de los pacientes7. La PCT podría utilizarse para identificar a niños con un mayor riesgo de mortalidad8. El péptido natriurético auricular (PNA) y la copeptina también demostraron asociación con la gravedad de los pacientes sépticos y la mortalidad de adultos en estado crítico9-16. La secreción de PNA está determinada principalmente por aumentos en la presión auricular transmural17, modulando la permeabilidad del endotelio con efectos sobre la homeostasis del volumen y la presión arterial18. La arginina-vasopresina (AVP) es secretada en respuesta a estímulos osmóticos o hemodinámicos. La copeptina es la porción C-terminal de la provasopresina19-21. Se ha sugerido que es un marcador individual del nivel de estrés22 con valores elevados durante infecciones sistémicas23. Sus niveles se han relacionado con el riesgo de mortalidad en pacientes adultos13,24,25.
De manera reciente, tenemos disponibles pruebas de laboratorio para determinar la región media del pro-PNA (RM-proPNA) y las concentraciones de copeptina. Estos péptidos se sintetizan, respectivamente, con PNA y AVP, pero tienen la ventaja de una vida media más larga (PNA, 5-10 min vs. RM-proPNA, 100-120 min; AVP, 5-10 min vs. copeptina, ex vivo, varios días), lo que los hace más adecuados para la práctica clínica diaria10,17,26.
Pensamos que sería interesante comprobar si la asociación descrita en adultos se presenta también en la infancia, ya que hasta el momento no hay datos disponibles sobre la relación de estos marcadores con el aumento de riesgo de mortalidad en pacientes pediátricos. Por ello, el objetivo de nuestro estudio fue determinar los niveles de RM-proPNA, copeptina y PCT durante las 12 primeras horas tras el ingreso en la UCIP, para examinar la hipótesis de que concentraciones elevadas de estos marcadores se podrían asociar con un mayor riesgo de mortalidad. Como objetivo secundario también examinamos la hipótesis de que niveles elevados de estos marcadores se podrían asociar a un mayor número de fallo de órganos.
Pacientes y métodosEstudio observacional realizado en 2 UCIP de hospitales universitarios. El estudio fue evaluado y aprobado por el Comité Ético de Investigación del Hospital Universitario Central de Asturias. Se solicitó consentimiento informado a todos los padres y a los niños mayores de 12 años. La muestra estuvo formada por 254 pacientes de edad inferior a 19 años. Los neonatos no fueron incluidos. Para la inclusión en el estudio era precisa la extracción por criterio clínico de una muestra de sangre en las primeras 12 h tras el ingreso y la firma del consentimiento informado. Se recogieron las siguientes variables: edad, peso, causa de ingreso en UCIP, diagnóstico y enfermedades previas. La frecuencia respiratoria, la frecuencia cardíaca, la presión arterial, la saturación de O2, la diuresis y la administración de agentes vasopresores se obtuvieron de forma horaria. El diagnóstico radiológico y microbiológico se realizó cuando estuvo indicado a criterio del médico responsable. Se recogieron hemocultivos cuando había sospecha clínica de infección o si la temperatura del paciente era superior a 38°C. El valor PIM 2 fue calculado al ingreso y el valor PRISM III durante las primeras 12h después del ingreso, tal como se realiza en la práctica clínica. Ambas escalas, PIM 2 y PRISM III, habían sido previamente validadas en ambas UCIP1. Las determinaciones bioquímicas de rutina, incluyendo PCT, se extrajeron durante las primeras 12 h después del ingreso. Las muestras de sangre venosa se recogieron en tubos que contenían ácido etilendiaminotetraacético (EDTA). Se congelaron alícuotas de plasma a −80°C para determinación posterior de RM-proPNA y copeptina.
Grupos según el riesgo de mortalidadLos pacientes fueron divididos en 2 grupos de acuerdo con los índices pronósticos de mortalidad. El grupo de riesgo alto de mortalidad (grupo A) incluía a pacientes con un índice pronóstico PIM 2 y PRISM III mayor al percentil 75 (n=33); el riesgo bajo de mortalidad (grupo B) incluía a pacientes con un PIM 2 y/o PRISM III menor o igual al percentil 75 (n=221).
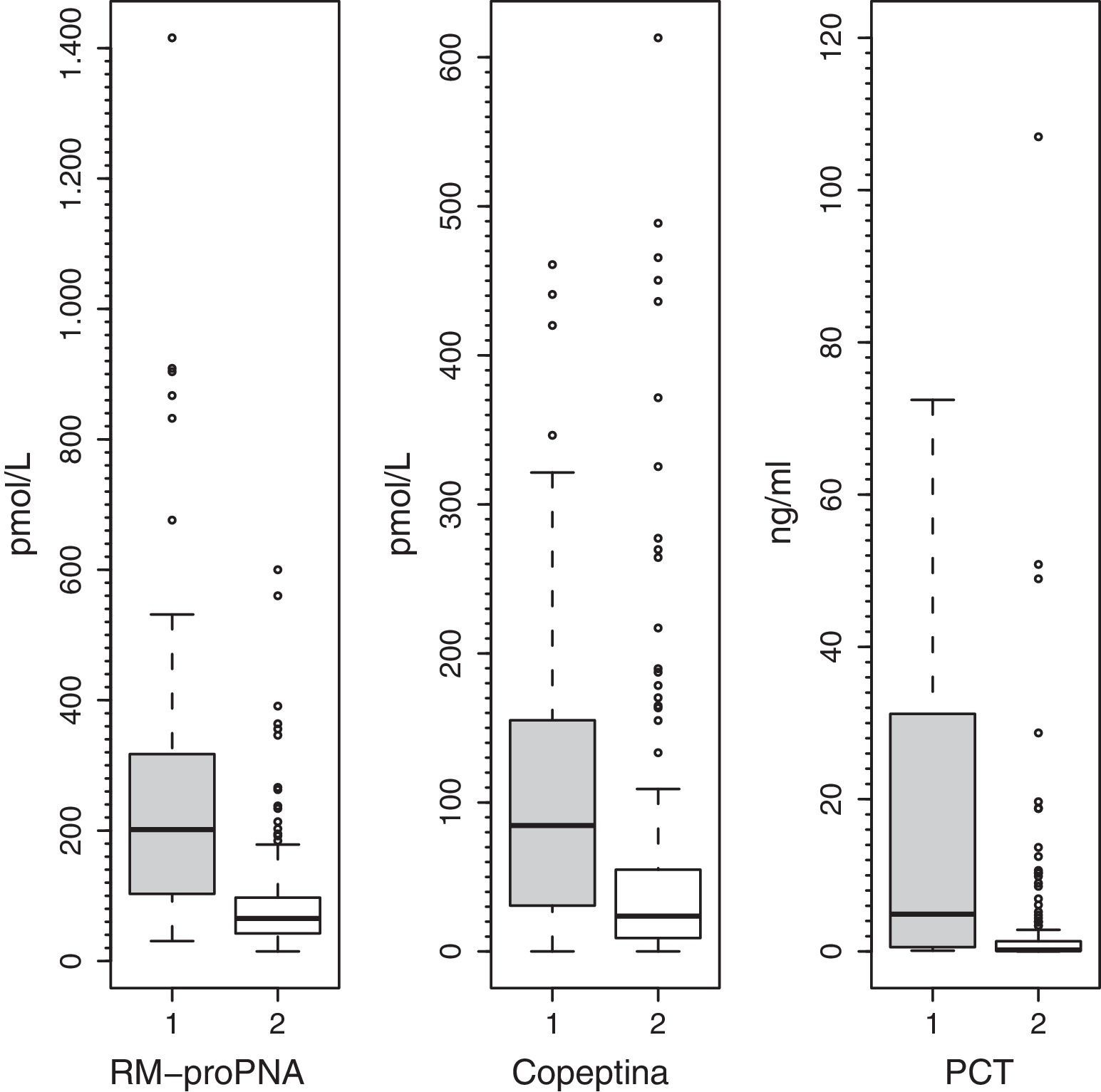
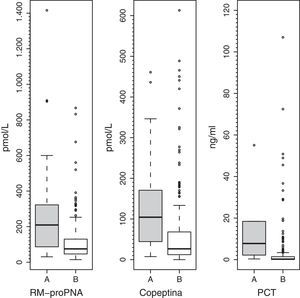
Grupos según el número de órganos en falloLos pacientes fueron divididos en 2 grupos según el número de órganos en fallo (cardiovascular, respiratorio, neurológico, hematológico, renal y hepático), de acuerdo con criterios de consenso27. El grupo 1 incluía a pacientes con número de órganos en fallo mayor de 1 (n=71), mientras que el grupo 2 incluía a pacientes con número de órganos en fallo menor de 2 (n=183).
Análisis bioquímico de región media del péptido natriurético proauricular y copeptinaLa RM-proPNA, la copeptina y la PCT se determinaron en plasma con EDTA usando una técnica de inmunoanálisis tipo sándwich (tecnología TRACE; Brahms GmbH, Hennigsdorf, Alemania). Los límites de detección analítica fueron 4,3pmol/l para la RM-proPNA, 4,8pmol/l para la copeptina y 0,02 ng/ml para la PCT.
Análisis estadísticoLas características clínicas de los pacientes y los valores de los marcadores se analizaron utilizando frecuencias, porcentajes, medianas y rangos. Las comparaciones entre los 2 grupos de pacientes (A vs. B; 1 vs. 2) se realizaron con el test de Mann-Whitney U para variables continuas y la prueba de la chi al cuadrado para variables categóricas. También se calcularon las curvas de rendimiento diagnóstico (ROC) y sus respectivas áreas bajo la curva (AUC), estimando un nivel del confianza (IC) del 95%. Posteriormente, se compararon tratando de establecer cuál era el marcador con mayor eficiencia diagnóstica para calcular el riesgo de mortalidad y el riesgo de fallo de órganos. Para tratar de compensar la pérdida de datos en las comparaciones pareadas, se usó el método de algoritmo bootstrap28 para comparar las AUC. Se utilizó el índice de Youden para establecer el valor del punto de corte con mayor sensibilidad y especificidad en la diferenciación de los diferentes grupos (A vs. B, y 1 vs. 2). Se consideró estadísticamente significativo un valor de p<0,05.
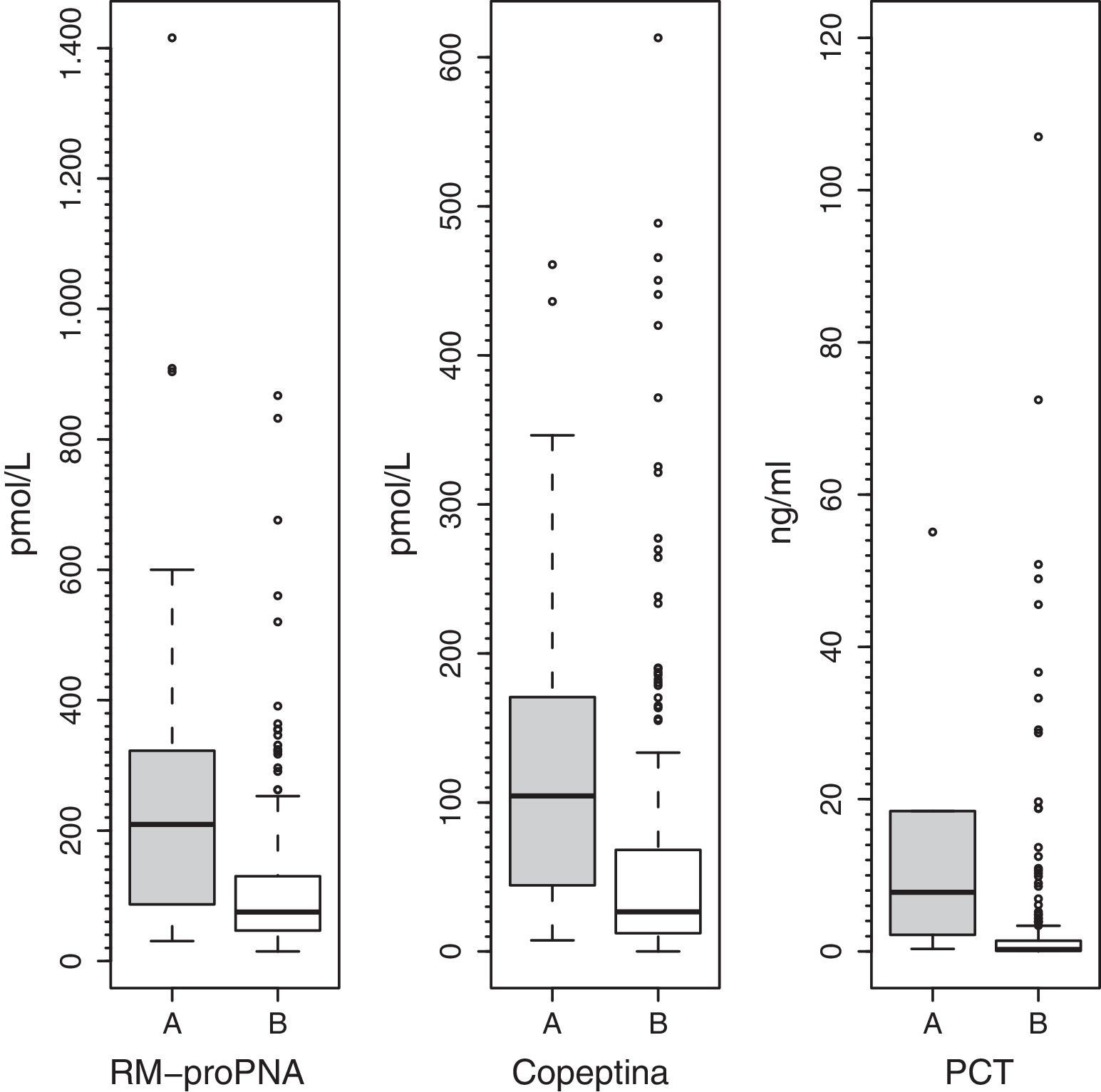
ResultadosCaracterísticas de la muestraSe incluyó a 254 pacientes en el estudio (150 varones). Las características demográficas, clínicas y de laboratorio se muestran en la tabla 1. Más de la mitad de la muestra era menor de 4 años. Los motivos principales de ingreso fueron postoperatorio, cirugía cardíaca, enfermedad respiratoria e infecciosa. Un total de 5 pacientes (2%) fallecieron durante la hospitalización en la UCIP. Los 5 pacientes se encontraban en el grupo con índice pronóstico de mortalidad elevado (grupo A). Los pacientes del grupo A tenían menor edad que los del grupo B.
Características demográficas y clínicas
| Características demográficas y clínicas | Población total N=254 | Grupo A (n=33) | Grupo B (n=221) | p |
|---|---|---|---|---|
| Edad al ingreso (meses) | 44 (0-224) | 19 (0-205) | 45 (0-224) | 0,012 |
| Peso (kg) | 15,0 (2,7-87,0) | 11,0 (3,0-74,0) | 16,0 (2,7-87,0) | 0,005 |
| Sexo varón (%) | 59,1 | 60,6 | 58,8 | 0,853 |
| Diagnóstico al ingreso | Población total N=254 | Grupo A (n=33) | Grupo B (n=221) | p |
|---|---|---|---|---|
| Postoperatorio (%) | 60 (23,6) | 1 (1,7) | 59 (98,7) | < 0,001 |
| Cirugía cardíaca (%) | 47 (18,5) | 21 (44,7) | 26 (55,3) | 0,560 |
| Respiratorio (%) | 45 (17,7) | 1 (2,2) | 44 (97,8) | < 0,001 |
| Infeccioso (%) | 40 (15,7) | 5 (12,5) | 35 (87,5) | < 0,001 |
| Traumatismo (%) | 17 (6,7) | 2 (11,8) | 15 (88,2) | 0,002 |
| Neurológico (%) | 10 (3,9) | 10 (100) | 0 (0) | – |
| Metabólico-renal (%) | 9 (3,6) | 1 (11,1) | 8 (88,9) | 0,039 |
| Otros (%) | 26 (16,8) | 2 (7,7) | 24 (92,3) | < 0,001 |
| PRISM III (valor absoluto) | 5,1±5,8 | 15,3±6,3 | 3,4±3,7 | < 0,001 |
| PIM 2 (%) | 2,8±7,9 | 11,2±18,5 | 1,4±2,5 | < 0,001 |
PRISM III y PIM 2 se expresan como media±desviación estándar, el diagnóstico al ingreso como valor absoluto y %, y el resto de las variables como mediana (rango).
Grupo A: grupo con mayor puntuación de riesgo de mortalidad; Grupo B: grupo con menor puntuación de riesgo de mortalidad.
Los valores plasmáticos de RM-proPNA, copeptina y PCT fueron significativamente más elevados en el grupo de pacientes con alto riesgo de mortalidad (grupo A) (fig. 1). Los valores plasmáticos de RM-proPNA, copeptina y PCT fueron significativamente más elevados en los pacientes con número de órganos en fallo mayor de 1 (grupo 1) (fig. 2).
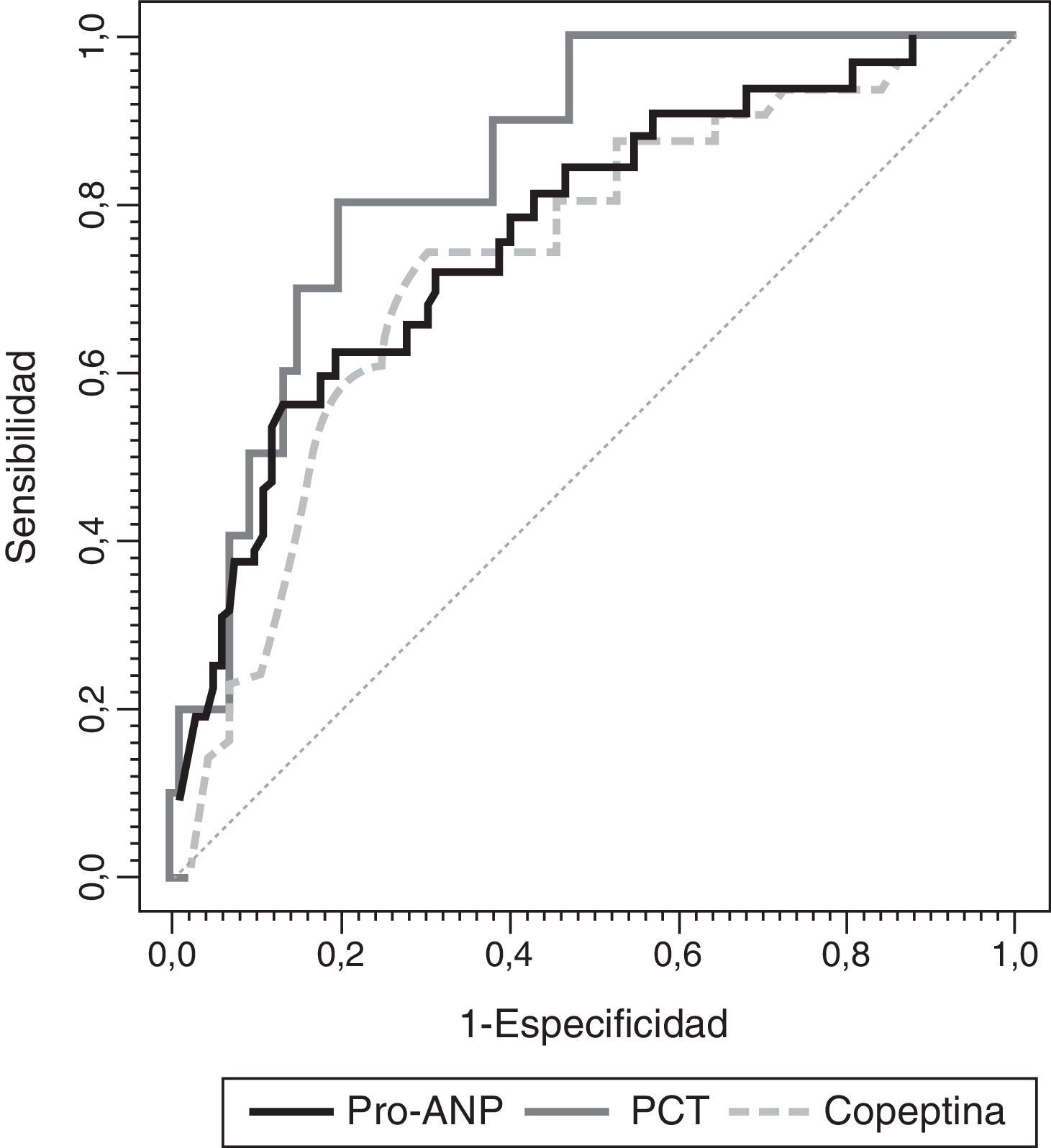
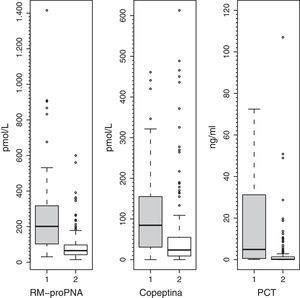
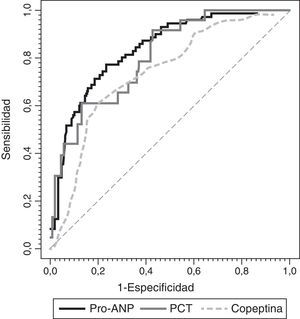
Para evaluar el valor de la RM-proPNA, copeptina y PCT en la predicción y riesgo de mortalidad en la UCIP se realizó un análisis de curvas ROC para cada biomarcador (fig. 3). No encontramos diferencias significativas entre las áreas bajo la curva ROC de los 3 biomarcadores. Una concentración de la RM-proPNA superior a 106pmol/l tenía una sensibilidad del 72% y una especificidad del 70%, mientras que una concentración de copeptina superior a 64pmol/l tenía un 70% de sensibilidad y un 74% de especificidad. El valor óptimo de corte de PCT para predecir riesgo de mortalidad era de 2 ng/ml, mostrando una sensibilidad y especificidad del 80%.
Curvas ROC de RM-proPNA, copeptina y PCT para predicción de puntuación de riesgo de mortalidad. Las áreas bajo la curva ROC fueron (intervalo de confianza del 95%): 0,842 (0,744-0,941) para PCT, 0,764 (0,674-0,854) para RM-proPNA y 0,735 (0,642-0,827) para copeptina. No había diferencias significativas entre los 3 marcadores (RM-proPNA vs. PCT, p=0,23; RM-proPNA vs. copeptina, p=0,64; PCT vs. copeptina, p=0,14).
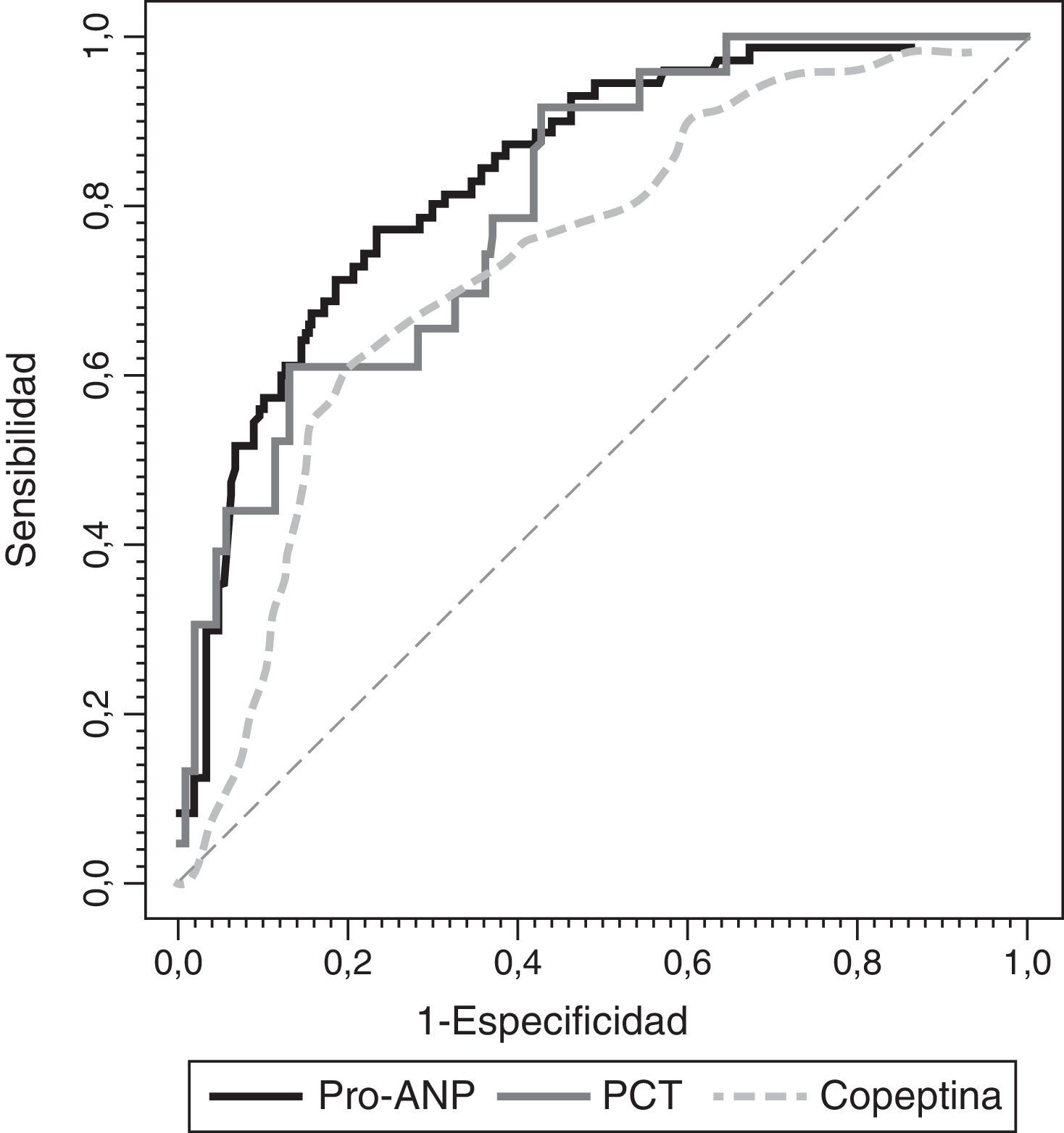
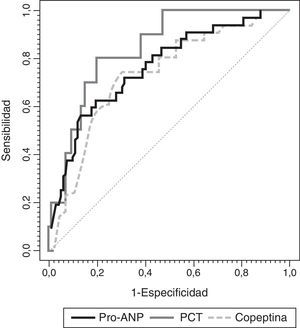
En la figura 4 se muestran las curvas ROC de cada biomarcador. Hubo diferencias significativas en el área bajo la curva ROC de la RM-proPNA vs. copeptina (p<0,01). No hubo diferencias significativas entre RM-proPNA y PCT, p=0,48, ni entre PCT y copeptina, p=0,21. Una concentración de RM-proPNA superior a 101pmol/l tenía una sensibilidad y una especificidad del 77%, mientras que una concentración de copeptina superior a 64pmol/l tenía una sensibilidad del 62% y una especificidad del 80%. Un valor de PCT de 4,1 ng/ml mostraba una sensibilidad del 69% y una especificidad del 88%.
Curvas ROC de RM-proPNA, copeptina y PCT para la predicción de número de órganos en fallo. Las áreas bajo la curva ROC fueron (intervalo de confianza de l95%): 0,804 (0,715-0,892) para PCT, 0,837 (0,784-0,891) para RM-proPNA y 0,735 (0,666-0,804) para copeptina. Había diferencias significativas entre MR-proPNA y copeptina, p=0,01. No había diferencias significativas entre MR-proPNA y PCT, p=0,48, o entre PCT y copeptina, p=0,21.
La mejora de la evaluación del pronóstico de los pacientes ingresados en las UCIP constituye un campo de investigación clínica relevante. Algunos biomarcadores podrían ayudar a estratificar a los niños críticamente enfermos en función de su riesgo de mortalidad1,8. En nuestro estudio, en una muestra heterogénea de niños gravemente enfermos, los niveles elevados de RM-proPNA, copeptina y PCT se asociaron a una mayor puntuación en las escalas de riesgo de mortalidad, así como a un mayor número de fallos de órganos.
La baja mortalidad de nuestra muestra, similar a las que se presentan actualmente en las UCIP de países desarrollados, nos obligó a utilizar como referencia en la medición del pronóstico las puntuaciones de riesgo de mortalidad derivadas de escalas previamente validadas en nuestras UCIP1. Este hecho dificulta la comparación de nuestros resultados con los obtenidos en población adulta, si bien cabe destacar que todos los pacientes que fallecieron pertenecían al grupo de puntuación de alto riesgo mortalidad. Así mismo, nos obligó a utilizar un segundo patrón de referencia de gravedad como es el fallo de órganos. Más del 90% de los pacientes con mayor riesgo de mortalidad había tenido 2 o más órganos en fallo.
Hasta la fecha, se disponen de pocos datos sobre el potencial de la RM-proPNA en la determinación del riesgo de mortalidad, especialmente en pediatría. En pacientes adultos sépticos fue evaluada como marcador de gravedad, con resultados prometedores9. El aumento de los niveles de RM-proPNA al ingreso en pacientes críticamente enfermos se ha asociado con una mayor mortalidad9-11. En nuestro estudio hemos obtenido un AUC ROC de 0,76 para identificar a los niños críticamente enfermos con diferente predicción de riesgo de mortalidad. En este sentido, se han encontrado diferentes AUC ROC en distintos estudios: 0,72 en el estudio de Lipinska et al.10 y Nowak et al.12, 0,88 en el estudio de Morgenthaler et al.9 y 0,89 en el estudio de Wang et al.29. Nuestro valor de corte de 106pmol/l fue menor que el valor de corte de estas series de pacientes adultos. La razón podría ser que dichos estudios se han realizado en pacientes diferentes de los que presentamos en nuestro estudio, y con diferente metodología. Nosotros estudiamos una cohorte de niños y en nuestros pacientes tratamos de diferenciar la predicción del riesgo de mortalidad al nivel del percentil 75, mientras que en las publicaciones revisadas9,11,12,29,30 se estudiaron poblaciones de adultos intentando diferenciar los supervivientes de los no supervivientes. En el estudio de Lipinska et al.10 solo se incluyó a pacientes con sepsis. En otro estudio realizado en adultos por Berendes et al.31 no se encontraron diferencias entre los niveles de RM-proPNA y el riesgo de mortalidad.
Respecto a la copeptina, los trabajos publicados en adultos encontraron AUC ROC que iban desde 0,70 en el estudio de Seligman et al.32 hasta 0,87 en el de Du et al.14, con valores intermedios de 0,75 en el estudio de Morgenthaler et al.13 y 0,83 en el de Lin et al.33. Nuestro resultado de 0,73 se encuentra dentro de estos valores. Encontramos un valor de corte de 64pmol/l, similar a los valores de corte de 64,8 y 62,7pmol/l de Seligman et al.32 y Du et al.14, respectivamente. Lin et al.33 publicaron un valor de corte de 52,7pmol/l, ligeramente inferior a los publicados en otros estudios. Los niveles de PCT altos también mostraron un AUC ROC aceptable para predecir el riesgo de muerte, siendo ya conocido que los niveles de PCT aumentan en relación directa con la gravedad de la enfermedad7,34-36.
Como era de esperar, el rendimiento de la RM-proPNA, la copeptina y la PCT para identificar a los pacientes con fracaso de más de un órgano fue similar al descrito anteriormente en relación con la predicción de riesgo de mortalidad. Los valores de las AUC ROC para diferenciar los grupos 1 y 2 eran aceptables para copeptina y buenos para la PCT y la RM-proPNA (fig. 4). El valor de corte de la PCT (4,1 ng/ml) fue más alto que el valor de corte para la predicción del riesgo de mortalidad (2,0 ng/ml), mientras que los valores de corte de la RM-proPNA y la copeptina fueron similares. Varios estudios han encontrado una correlación entre el aumento de la PCT durante las primeras 24 h después del ingreso37 o el aumento postoperatorio de la PCT38 y el número de órganos que fracasan. Lipinska et al.10 y Boeck et al.11 demostraron una correlación entre los niveles de RM-proPNA y la escala de fallo multiorgánico. No encontramos ningún estudio que analizase la capacidad de la copeptina como marcador de fracaso multiorgánico. En resumen, la información proporcionada por estos marcadores podría mejorar la detección de los pacientes con mayor puntuación en escalas de riesgo de mortalidad y el fracaso de más de un órgano.
Las escalas PRISM III y PIM 2 han sido validadas para la estratificación del riesgo de mortalidad, pero suelen emplearse más en el ámbito de la gestión sanitaria y de la investigación que para la toma de decisiones clínicas1,3,5. Por ello, podría ser útil contar con un parámetro bioquímico disponible de forma rápida que proporcionase una información similar. Nuestro grupo había observado en esta misma cohorte de pacientes8 que la región media de la proadrenomedulina (RM-proADM) también era capaz de predecir el riesgo de mortalidad (AUC: 0,866; IC del 95%: 0,810-0,921) y el número de fracaso de órganos (AUC: 0,922; 0,887-0,957). Al comparar las AUC, se hallaron diferencias estadísticamente significativas entre la RM-proADM y la RM-proPNA (p<0,05), y entre la RM-proADM y la copeptina (p<0,01). Por tanto, en nuestra cohorte de pacientes la RM-proADM mostró una mayor capacidad predictiva que la RM-proPNA y que la copeptina. Varios estudios recientes también han mostrado que los niveles de RM-proADM pueden ser buenos indicadores de gravedad en pacientes críticos, tanto niños8,39 como adultos13. Para confirmar nuestros resultados, futuros estudios deberán investigar si la RM-proADM tiene una mayor capacidad predictiva de pronóstico que los otros 3 marcadores.
Nuestro estudio tiene varias limitaciones. En primer lugar, no hemos podido emplear la mortalidad como patrón de referencia para diferenciar el pronóstico de los pacientes porque la mortalidad era baja en nuestra muestra. Hemos usado como alternativa escalas de riesgo de mortalidad y número de fracaso de órganos, siendo conscientes de sus limitaciones. En segundo lugar, hemos realizado un estudio observacional que no nos permite obtener conclusiones en cuanto a intervenciones terapéuticas. En tercer lugar, nuestros resultados no pueden tomarse como representativos de todas las UCIP de España u otros países, ya que la muestra ha sido recogida únicamente de 2 UCIP. La capacidad de predicción podría ser distinta en caso de que la población fuera diferente. En cuarto lugar, los biomarcadores fueron analizados dentro de las primeras 12 h de ingreso en la UCIP. La evolución de los mismos a lo largo de los primeros días de ingreso podría aumentar su precisión.
ConclusiónLos niveles elevados de RM-proPNA, copeptina y PCT se asocian a aumento de las puntuaciones de riesgo de mortalidad. No hay diferencias significativas entre los 3 marcadores. La RM-proPNA muestra mejor asociación con el número de fallo de órganos que la copeptina.
FinanciaciónFinanciado parcialmente con una beca de la «Fundación Ernesto Sánchez Villares». Los kits para la determinación de la RM-proPNA y la copeptina fueron facilitados por Brahms GmbH (Hennigsdorf, Alemania).
Conflicto de interesesCorsino Rey ha recibido financiación por parte de las compañías Brahms y Thermofisher para impartir conferencias en congresos sobre temas relacionados con biomarcadores y sepsis. El resto de los autores no declaran conflicto de intereses. La Fundación Ernesto Sánchez Villares y las compañías Brahms y Thermofisher no han tenido ninguna participación en el desarrollo del manuscrito, incluyendo el diseño del estudio, la recogida y análisis de los datos, la redacción del mismo y la decisión de enviarlo a publicar.
Al personal médico y de enfermería de las UCIP del Hospital Universitario Central de Asturias y del Hospital Universitario Gregorio Marañón. Al personal del Servicio de Bioquímica del Hospital Universitario Central de Asturias.